Os gráficos apresentam dados cinéticos de uma mesma reação r...
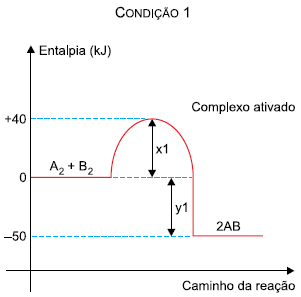
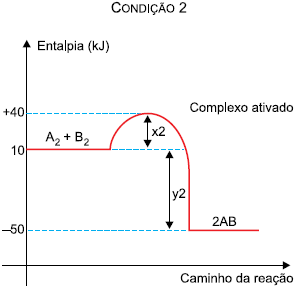
Na comparação entre as duas condições, verifica-se que:
- Gabarito Comentado (1)
- Aulas (5)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
A) CORRETA - Conforme citado acima, na condição 2, a energia de ativação (x2) vale 30 kJ, enquanto que na condição 1 (x1) vale 40 kJ. Portanto, há uma diminuição da energia de ativação na condição 2.
B) INCORRETA - A reação é exotérmica e a energia liberada é definida como a entalpia dos produtos menos a dos reagentes, dada por y1 (- 50 kJ), na condição 1, e y2 (- 60 kJ), na condição 2. Como na condição 1 são liberados 50 kJ e na 2 são liberados 60 kJ, há maior liberação de energia nessa condição.
C) INCORRETA - Quando há a presença de um catalisador as substâncias partem de um mesmo estado de energia, e ocorre uma diminuição da energia de ativação e também do complexo ativado. Apesar da energia de ativação ter diminuído na condição 2 a energia do complexo ativado continua a mesma observada na condição 1.
D) INCORRETA - A energia de ativação de 1 é maior e, devido a isso, a reação é mais lenta, pois demora mais para que o complexo ativado seja formado.
E) INCORRETA - A energia do complexo ativado é a mesma em ambas as condições (40 kJ).
Gabarito do Professor: Letra A.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
A energia de Ativação é a energia mínima para ocorrer a reação.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo