Questões de Vestibular de Química - Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Foram encontradas 270 questões
De tempos em tempos, o mundo se choca com notícias sobre o uso de armas químicas em conflitos. O sarin é um composto organofosforado líquido, insípido, incolor e inodoro, altamente volátil, que se transforma em gás quando exposto ao ar, sendo um dos principais alvos dessas notícias. Em 1955, um projeto confidencial do exército americano estudou a eficiência de hipoclorito na eliminação de sarin em ambientes contaminados. A tabela a seguir mostra alguns resultados obtidos nesse estudo.
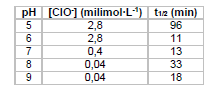
Sendo t1/2 o tempo para a concentração do sarin cair à
metade, de acordo com a tabela a reação é mais rápida em
Foi proposto a um grupo de alunos um experimento sobre a reação da casca de ovos com soluções de ácido clorídrico (HCl), usando os materiais e as condições descritas na tabela.
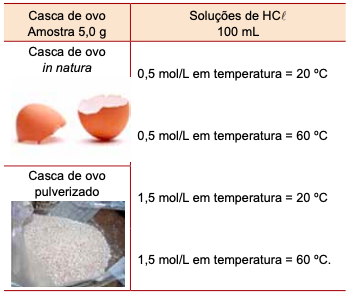
(http://www.saude.co/ e www.animalnatural.com.br. Adaptado)
O experimento consistia em medir o tempo da reação da solução ácida com a amostra de casca de ovo. Para a preparação do experimento, foi removida a película de material orgânico que compõe a casca de ovo, tanto para o seu uso in natura como para preparação da amostra em pó.
A combinação que apresentou o menor tempo de reação foi
aquela que usou
I. NO2(g) + SO2(g) + H2O(v) → H2SO4(aq) + NO(g)
II. 2NO(g) + O2(g) → 2NO2(g)
O Grande Nevoeiro, uma névoa mortífera que escureceu Londres por cinco dias, em dezembro de 1952, vitimou 12 mil londrinos e 150 mil pessoas foram hospitalizados em consequência de infecção respiratória. O fenômeno foi esclarecido, por completo, em novembro de 2016, através de estudos feitos por uma equipe de cientistas de dezenove universidades, incluindo-se americanos, ingleses e chineses. A névoa continha ácido sulfúrico, H2SO4(aq), em suspensão no ar atmosférico produzido, como mostram as equações químicas em destaque. O dióxido de enxofre SO2(g) se combinou com dióxido de nitrogênio, NO2(g), gases provenientes da combustão de carvão usado no aquecimento interno de residências e nas fábricas. Em Londres da década de 50, se jogavam 390 toneladas de SO2(g) no ar. Mas, atualmente, a concentração de dióxido de enxofre no ar atmosférico londrino foi reduzida de 330μgm−3 para quase zero. A névoa de poluição que se alastra pelas cidades chinesas, na atualidade, pode atingir a toxicidade do Grande Nevoeiro de Londres.
A fim de aumentar a velocidade de formação do butanoato de etila, um dos componentes do aroma de abacaxi, emprega-se como catalisador o ácido sulfúrico. Observe a equação química desse processo:
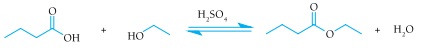
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do
ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:

Considere um experimento em que uma enzima, cuja constante de Michaelis é igual a 9 x 10−3 milimol/L, foi incubada em condições ideais, com concentração de substrato igual a 10−3 milimol/L. A velocidade de reação medida correpondeu a 10 unidades. Em seguida, a concentração de substrato foi bastante elevada de modo a manter essa enzima completamente saturada.
Neste caso, a velocidade de reação medida será, nas mesmas unidades, equivalente a: