Questões de Vestibular FUVEST 2017 para Vestibular - Primeira Fase
Foram encontradas 90 questões

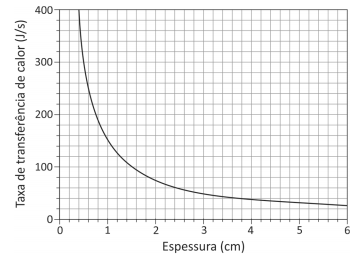
Considerando 1 cal = 4 J, a menor espessura do colchão, em cm, para que a pessoa durma confortavelmente é
 Em uma câmera digital que utilize uma lente convergente com
20 mm de distância focal, a distância, em mm, entre a lente e o
sensor da câmera, quando um objeto a 2 m estiver
corretamente focalizado, é, aproximadamente,
Em uma câmera digital que utilize uma lente convergente com
20 mm de distância focal, a distância, em mm, entre a lente e o
sensor da câmera, quando um objeto a 2 m estiver
corretamente focalizado, é, aproximadamente,π= 3. Calor latente de vaporização da água: 2 x 106 J/kg. Densidade da água: 103 kg/m3. 1 dia = 8,6 x 104 s.
Note e adote: Considere o ar em repouso e ignore sua resistência. Ignore as dimensões das pessoas envolvidas. Velocidade do som no ar: 360 m/s. Aceleração da gravidade: 10 m/s2.
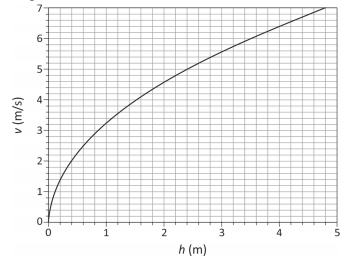
Uma onda no mar, onde a profundidade da água é 4,0 m, tem comprimento de onda igual a 50 m. Na posição em que a profundidade da água é 1,0 m, essa onda tem comprimento de onda, em m, aproximadamente igual
Note e adote: Aceleração da gravidade: 10 m/s2. Desconsidere a massa dos motoristas e a resistência do ar.
Corda I II III IV V Tensão de ruptura (N) 4.200 7.500 12.400 20.000 29.000
Ele tem também que incluir no projeto uma margem de segurança; esse fator de segurança é tipicamente 7, ou seja, o balanço deverá suportar cargas sete vezes a tensão no ponto mais baixo da trajetória. Admitindo que uma pessoa de 60 kg, ao se balançar, parta do repouso, de uma altura de 1,2 m em relação à posição de equilíbrio do balanço, as cordas que poderiam ser adequadas para o projeto são Note e adote: Aceleração da gravidade: 10 m/s2 . Desconsidere qualquer tipo de atrito ou resistência ao movimento e ignore a massa do balanço e as dimensões da pessoa. As cordas são inextensíveis
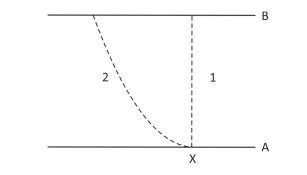
Considere a carga do elétron igual a -1,6 x 10-19 C e as seguintes afirmações com relação à energia cinética de um elétron que sai do ponto X na placa A e atinge a placa B:
I. Se o elétron tiver velocidade inicial nula, sua energia cinética, ao atingir a placa B, será 3,2 x10-15 J. II. A variação da energia cinética do elétron é a mesma, independentemente de ele ter percorrido as trajetórias 1 ou 2. III. O trabalho realizado pela força elétrica sobre o elétron na trajetória 2 é maior do que o realizado sobre o elétron na trajetória 1.
Apenas é correto o que se afirma em
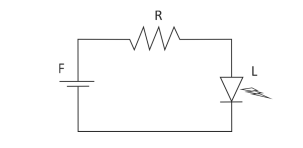
O valor da resistência do resistor (R), em Ω, necessário para que o LED opere com seus valores nominais é, aproximadamente,
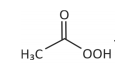 + H2O ⥬ composto 1 + H2O2
+ H2O ⥬ composto 1 + H2O2Ao abrir um frasco desse desinfetante comercial, é possível sentir o odor característico de um produto de uso doméstico. Esse odor é de
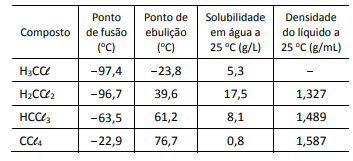
A melhor técnica de separação dos organoclorados presentes na fase líquida e o primeiro composto a ser separado por essa técnica são:
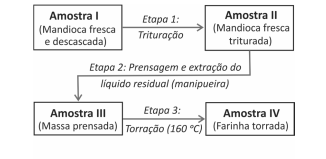
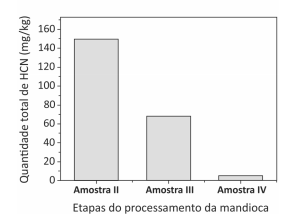
O que ocorre com o HCN nas Etapas 2 e 3?
As palavras que completam corretamente as lacunas são:

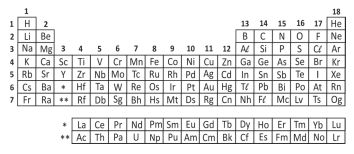
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
6 CO2 (g) + 6 H2O (g) → C6H12O6 (aq) + 6 O2 (g) C6H12O6 (aq) → 2 C2H5OH (l) + 2 CO2 (g) ∆H = -70 kJ/mol C2H5OH (l)+ 3 O2 (g) → 2 CO2 (g) + 3 H2O (g) ∆H = -1.235 kJ/mol
Com base nessas informações, podemos afirmar que o valor de ∆H para a reação de fotossíntese é
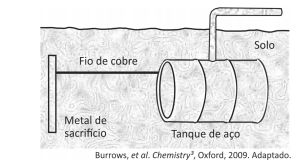
Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo ( + ) indica que foi observada uma reação química e o ( - ) indica que não se observou qualquer reação química.
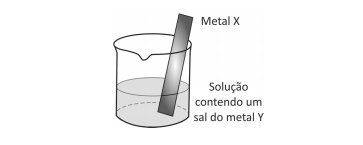
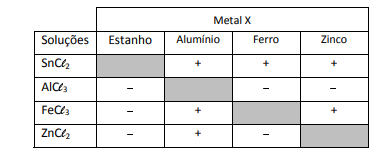 Da análise desses resultados, conclui-se que pode(m) ser
utilizado(s) como metal(is) de sacrifício para tanques de aço:
Da análise desses resultados, conclui-se que pode(m) ser
utilizado(s) como metal(is) de sacrifício para tanques de aço: Note e adote: o aço é uma liga metálica majoritariamente formada pelo elemento ferro.
Composto Alfa C7H8O
Para identificar a substância contida no frasco, foram feitos os seguintes testes:
I. Dissolveram-se alguns mililitros do líquido do frasco em água, resultando uma solução neutra. A essa solução, adicionaram-se uma gota de ácido e uma pequena quantidade de um forte oxidante. Verificou-se a formação de um composto branco insolúvel em água fria, mas solúvel em água quente. A solução desse composto em água quente apresentou pH = 4. II. O sólido branco, obtido no teste anterior, foi dissolvido em etanol e a solução foi aquecida na presença de um catalisador. Essa reação produziu benzoato de etila, que é um éster aromático, de fórmula C9H10O2.
Com base nos resultados desses testes, concluiu-se que o Composto Alfa é

A respeito dessas representações, é correto afirmar que os sistemas