Questões de Vestibular UEM 2011 para Vestibular - PAS - Etapa 2 - Francês
Foram encontradas 9 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
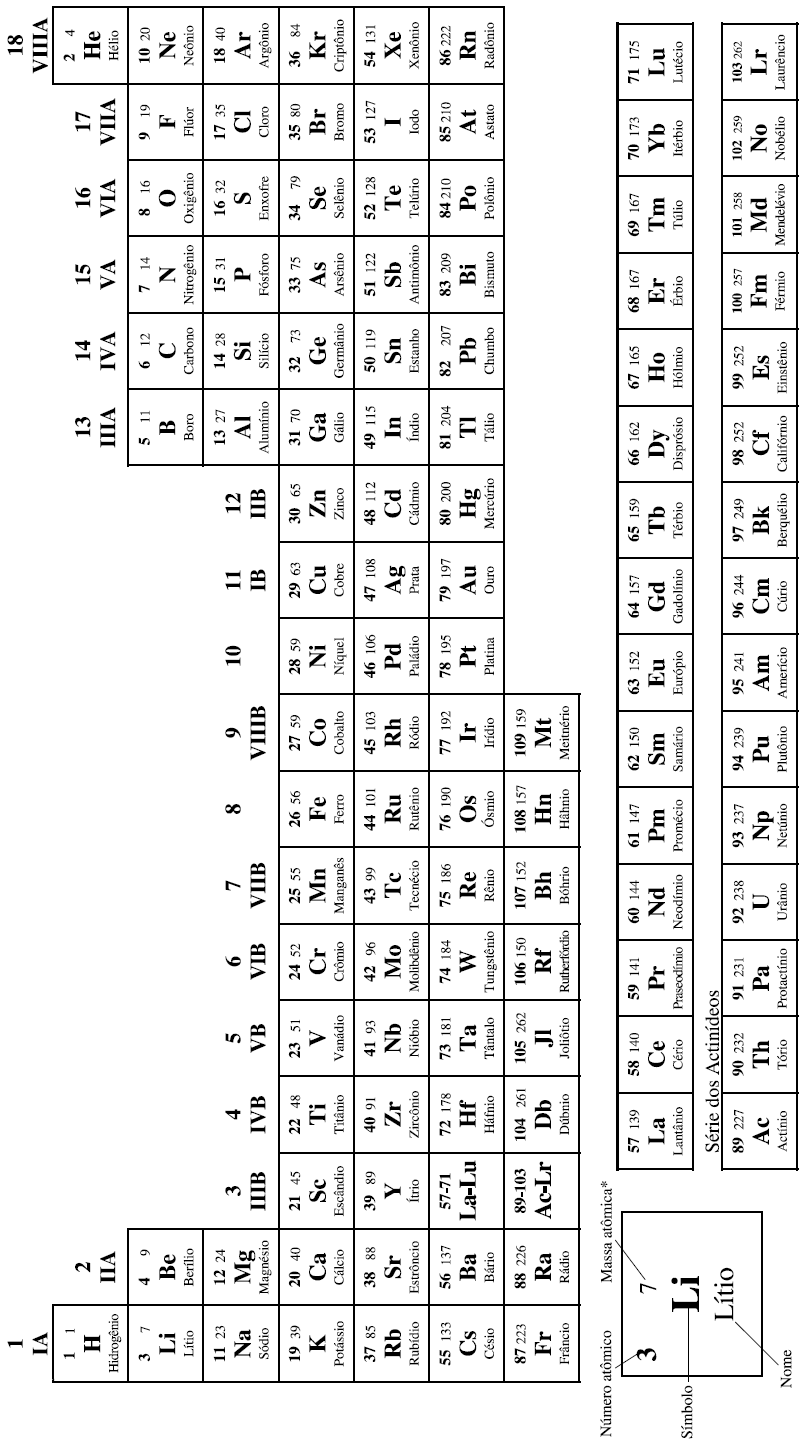
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol