O título em massa da solução de Ca(NO3)2, considerando-se a...
Próximas questões
Com base no mesmo assunto
Ano: 2011
Banca:
UEM
Órgão:
UEM
Provas:
UEM - 2011 - UEM - Vestibular - PAS - Etapa 2 - Inglês
|
UEM - 2011 - UEM - Vestibular - PAS - Etapa 2 - Francês |
Q1349963
Química
Texto associado
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
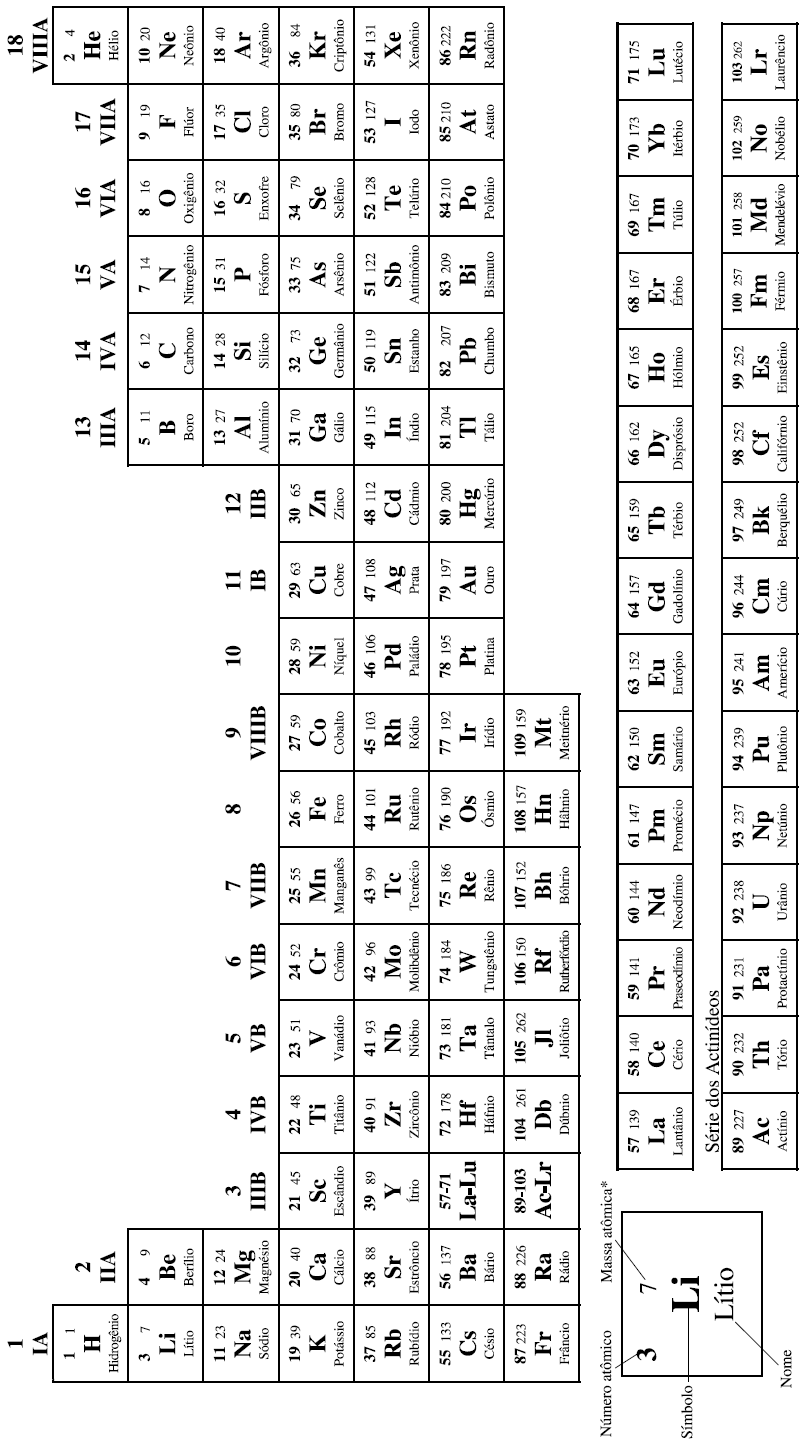
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
NH4NO3 = 80 g/mol, assinale a alternativa correta.
O título em massa da solução de Ca(NO3)2,
considerando-se a massa de 1,64 g desse sal
em 1,0 L de solução, é de 30%.