Questões de Vestibular UNICENTRO 2011 para Vestibular, Química 1
Foram encontradas 15 questões
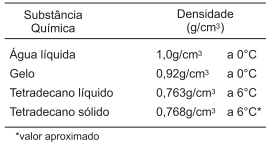
Dois tubos de ensaio fechados, sem rótulos, um contendo uma amostra de 10,0mL de água liquida, a 25oC, e outro, uma amostra de 15,0mL de tetradecano líquido, à mesma temperatura, foram colocados em um banho de gelo, após marcados aleatoriamente com os códigos XO e XB. Decorrido algum tempo, observou-se, no fundo do tubo de ensaio XB, a presença de uma fase sólida e, no tubo XO, a formação de uma fase sólida na superfície do líquido.
A partir da análise desses resultados experimentais obtidos nesses testes, é correto afirmar:
Os óxidos de nitrogênio, NO(g) e NO2(g), são poluentes ambientais responsáveis pela formação de ozônio, O3(g), na baixa atmosfera, nos grandes centros urbanos. Em um determinado experimento realizado com esses gases, em recipiente fechado, a concentração de NO2(g), em função do tempo, apresentou o comportamento mostrado no gráfico.
Uma análise dessas informações e desse gráfico permite
afirmar:
A indústria de alimentos e o Ministério da Saúde firmaram compromisso de reduzir gradualmente o teor de sódio, em 16 tipos de alimentos, até 2020. Segundo o Ministério da Saúde, o brasileiro consome, em média, 9,6g diárias de sal, NaCl, quando a Organização Mundial de Saúde, OMS, recomenda o consumo máximo de 5,0g diárias. O excesso de sal na dieta está associado a maior risco de doenças, como hipertensão, problemas cardiovasculares, renais e câncer.
Uma análise dessas informações e da tabela permite
corretamente afirmar:
A partir dessas informações e admitindo-se que esses gases são ideais, é correto afirmar:
As curvas de solubilidade têm grande importância no estudo das soluções de sólidos em líquidos, porque a temperatura é o único fator físico perceptível que influi na solubilidade. Há certas substâncias químicas cujas curvas de solubilidade apresentam pontos de inflexão que denotam mudanças de estrutura do soluto, como é possível verificar no gráfico da solubilidade do sulfato de sódio decaidratado, Na2SO4.10H2O.
A análise desse gráfico permite corretamente afirmar:
O nitrato de amônio NH4NO3(s) é utilizado na agricultura como fertilizante para promover o crescimento e a frutificação de plantas, entretanto é um explosivo potente que, ao se decompor, libera, rapidamente, um volume muito grande de gases de acordo com a equação termoquímica.
A partir dessas informações, dessa equação termoquímica e admitindo-se que os gases desprendidos na explosão são ideais, é correto afirmar:
I. FeCO3(s) + CO2(g) + H2O(l) ⇌ Fe2+(aq) + 2HCO-3 (aq)
II. 4Fe2+(aq) + 8HCO-3 (aq) + O2(aq) ⇌ 2Fe2O3(s) + 8CO2(g) + 4H2O(l)

As propriedades curativas atribuídas à água de Itaparica da Reserva Venceslau, — nome dado em homenagem a um dos primeiros ecologistas da Ilha de Itaparica, — são consequências da presença de íons Fe2+(aq) dissolvidos. Esses íons são responsáveis pela formação de depósitos de Fe2O3(s), de cor marrom, em pisos e azulejos, de acordo com o sistema em equilíbrio I e a equação química II.
A partir dessas informações e dessas equações, é correto afirmar:
CH3COOH(aq) + H2O(l) ⇌ CH3COO− (aq) + H+ (aq)
Equilíbrio iônico é o caso particular de equilíbrio químico em que aparecem íons. Os íons estão presentes em várias soluções aquosas encontradas na natureza e nos organismos dos seres vivos. Dos equilíbrios químicos iônicos em solução aquosa, um dos mais importantes é o que ocorre na ionização de ácidos e de bases. A concentração desses íons depende, entre outros fatores, do grau de ionização, α, e do valor da constante de ionização, Ka.
Desse modo, considerando-se uma solução de ácido acético 0,02 mol L−1 , cujo grau de ionização, α, é igual a 3%, em equilíbrio químico representado pela equação química, é correto afirmar:
A ONU insiste na necessidade de uma revolução verdadeiramente “verde” na agricultura, que proteja ao mesmo tempo o ambiente, por meio da utilização de métodos de cultivo, que evitem o desperdício dos recursos naturais e reduzam o consumo de insumos químicos.
A discussão sobre a problemática da fome, o modelo de agricultura atual e o adotado pelos países periféricos permitem apontar corretamente para
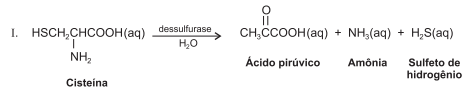
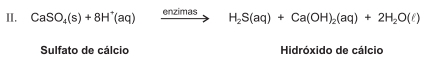
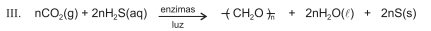
As plantas utilizam enxofre, sob forma de sulfato, SO2-4 , para a síntese dos aminoácidos cisteína, cistina e meteonina, que são componentes essenciais de algumas proteínas. Quando as plantas morrem, os micro-organismos do solo degradam as proteínas e liberam aminoácidos, que, por sua vez, são degradados por enzimas dessulfurase, como mostra a equação química I. O íon sulfato pode ser transformado em sulfeto de hidrogênio, H2S, por vários organismos do solo, como as bactérias dessulfotomaculum, que podem realizar a reação de acordo com a equação química II.
Algumas espécies de bactérias fototrópicas verdes e púrpuras podem oxidar sulfeto de hidrogênio a enxofre elementar, conforme evidencia a equação química III.
A partir da análise dessas considerações sobre as transformações do enxofre na natureza, é correto afirmar:
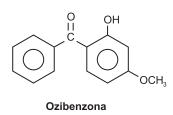
Os protetores solares ajudam a bloquear as radiações, UV, antes de causar danos à pele. A eficiência dessas substâncias está relacionada à solubilidade em água, fator preponderante na remoção desses compostos da pele, o que diminui o tempo de proteção à radiação UV.
Dentre os protetores solares, estão as cetonas de estrutura aromática, a exemplo do 2-hidroxi-4-metoxibenzofenona, a ozibenzona, representada pela fórmula estrutural.
De acordo com essas considerações, sobre os protetores solares, é correto afirmar:
Considerando-se essas informações, é correto afirmar:
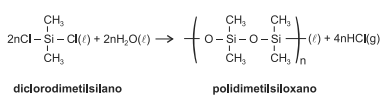
Os silicones foram criados em 1943 e são preparados, geralmente, a partir da reação química de diclorodialquilsilano com água,
representada pela equação química. Dependendo dos grupos orgânicos presentes e do tamanho da cadeia orgânica, o silicone
pode variar de líquido extremamente fluido a graxa viscosa, até mesmo sólido semelhante à borracha. O polímero é utilizado
na fabricação de próteses, reparadores de pontas para cabelos, antiespumantes não aquosos e uma infinidade de produtos.
A partir dessas informações sobre os silicones, é correto afirmar: