Muitos laboratórios armazenam em seus estoques soluções con...
Muitos laboratórios armazenam em seus estoques soluções concentradas de reagentes. Um técnico responsável dispõe, em seu laboratório, de uma solução de etanol (álcool absoluto) a 16,3 mol/L. O volume de água, em litros, que deve ser adicionado a 400 mL de solução de etanol a 16,3 mol/L (álcool absoluto) para produzir etanol hidratado a 70 % v/v é, aproximadamente:
(Dado: detanol = 0,8 g/mL)
- Gabarito Comentado (1)
- Aulas (11)
- Comentários (2)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Esta questão
relaciona conceitos importantes para o preparo de soluções.
É desejado
preparar uma solução final de etanol hidratado com concentração igual a 70 %v/v,
a partir de uma solução inicial de etanol com concentração de 16,3 mol/L com
volume igual a 400 mL. Primeiramente é preciso organizar os dados para resolver
a questão:
Concentração
molar do etanol (MEtanol) = 16,3 mol/L;
Volume da solução de etanol (VSol. Etanol) = 400 mL = 0,4 L;
Concentração do etanol hidratado (CSol. Etanol hidratado) = 70 % v/v;
Densidade do etanol (dEtanol) = 0,8 g/ml;
Massas
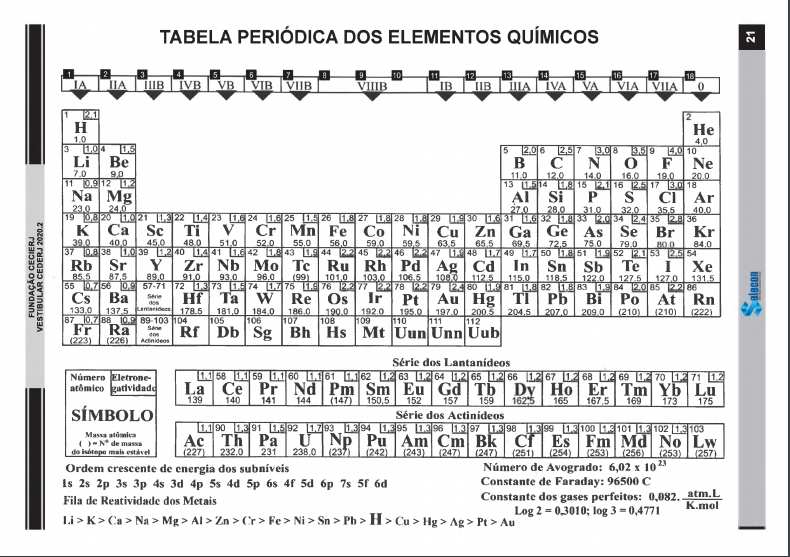
molares (fornecidas pela tabela periódica, em g/mol): C = 12; H = 1; O = 16.
1) Para
calcular o volume de água que deve ser adicionado para a obtenção da solução de
etanol com concentração 70 %v/v é preciso calcular o número de mols de etanol
contido na solução inicial, a partir da concentração molar e do volume (em litros):
nEtanol
= MEtanol × VSol. Etanol = 16,3
× 0,4 = 6,52 mol
2) Com o
número de mols é possível saber a massa de etanol na solução inicial, que será
a mesma da solução final, uma vez que para a obtenção da solução de etanol
hidratado apenas água será adicionada (diluição). A massa pode ser determinada
a partir da massa molar do etanol.
Esse composto é um álcool e possui dois carbonos (prefixo et), uma hidroxila (grupo que caracteriza a função álcool quando ligada a um carbono saturado) e seis hidrogênios (pois o carbono faz 4 ligações). Sua fórmula molecular é, dessa forma, C2H6O. Sua massa molar (MM) pode ser obtida a partir das massas molares dos elementos presentes nesse composto:
MMEtanol
= 2 × MMC + 6 × MMH
+ MMO = 2 × 12 + 6 × 1 + 16 = 46 g/mol
Com a massa molar
podemos calcular a massa de etanol presente nas soluções por regra de três,
considerando o número de mols calculado:
1 mol de Etanol possui 46 g
6,52 mol ------- m
mEtanol
= 46 × 6,52 = 299,92 g
3) A
densidade do etanol indica quantos gramas estão presentes na solução de etanol
inicial, assim, é possível saber o volume de etanol puro nessa solução por
regra de três, considerando a massa calculada acima:
0,8 g de Etanol presente em 1 mL
299,92 g ------------- VEtanol puro
VEtanol
puro = 299,92/0,8 = 374,9 mL
4) Com o
volume de etanol puro é possível saber o volume da solução de etanol hidratado.
A concentração em % volume/volume possui a seguinte expressão:
C = (Vsoluto/Vsolução) × 100
Assim,
tem-se que:
C = (VEtanol
puro/VSol. Etanol hidratado) × 100
Substituindo
os valores:
70/100 = 374,9/VSol. Etanol hidratado
VSol. Etanol hidratado = 374,9/0,7
VSol. Etanol
hidratado = 535,6 mL
5) Por fim,
com o volume total da solução de etanol hidratado, basta diminuir o valor do
volume da solução de etanol inicial para saber o volume de água adicionado:
Vágua = VSol. Etanol hidratado – VSol. Etanol
Vágua =
535,6 – 400 = 135,6 mL = (135,6/1000) L = 0,135 L
Gabarito da Professora: Letra A.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
1° PASSO: colocar as concentrações na mesma unidade
M x MM = 1000 x d x T
M = (1000*0,8*0,7)/(46)
M = 12,17 mol/L
2° PASSO: calcular o volume final da diluição
Mi x Vi = Mf x Vf
Vf = (16,3*0,4)/12,17
Vf = 0,535 L
3° PASSO: encontrar o volume de água add
Vagua = Vfinal - Vinicial
Vagua = 0,535 - 0,4 = 0,135 L
SE 1L tem 16,3.
400ml tem 6,4mol.
regra de 4
6,4 ta para 400
70% está para 1L
isso dá 437,5
como a densidade é 0,8 divide-se 437,5 por 0,8 = 546 ml
546-400 (inicial)= 146ml de agua aprox
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo