A cal, muito utilizada na construção civil, é obtida na indú...
A cal, muito utilizada na construção civil, é obtida na indústria a partir da reação de decomposição do calcário, representada pela equação:
CaCO3(s) 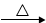 CaO(s) + CO2(g)
CaO(s) + CO2(g)
A fonte de calor para essa decomposição pode ser o gás natural,cuja reação de combustão é representada por:
CH4(g) + 2O2(g) → 2H2O(l) + CO2(g)
Considerando as massas molares:
H = 1,0 g·mol–1 , C = 12,0 g·mol–1 ,
O = 16,0 g·mol–1 , Ca = 40,0 g·mol–1 ,
a massa de gás carbônico lançada na atmosfera quando são produzidos
560 kg de cal, a partir da decomposição térmica do calcário,
utilizando o gás natural como fonte de energia, é:
Comentários
Veja os comentários dos nossos alunos
Massa de 1 mol calcário = 100 u = 100g
1 mol de calcário produz 44g de CO2.
1 mol de calcário produz 56g de CaO.
Vamos raciocinar: Quanto de calcário usaremos para produzir 560kg de cal?
100g -- 56g
x -- 560kg
x = 1000kg
Lei de Lavoisier: A soma das massas dos reagentes é igual a soma das massas dos produtos. Assim a massa m de CO2 será:
1000 = 560 + m
m = 440kg
Veja que para produzir calor para decompor o CaCO3, é necessário queimar o gás natural, que também produz CO2. Como não temos informações suficientes para calcular a massa de CO2 produzida na combustão do gás, só podemos dizer que a massa de CO2 é maior que 440kg, e é por isso que a resposta correta é a letra E.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo