Para diferenciar os hidrocarbonetos etano e eteno em uma mis...
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
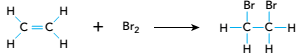
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:
- Gabarito Comentado (1)
- Aulas (23)
- Comentários (4)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
http://pensebemaulas.com/vestibular-uerj-2016-questao-43-de-quimica/
Após deve-se fazer o cálculo estequiométrico:
Eteno ------------ haleto
28g -------------- 188g
X ---------------- 940g
X = 140 gramas de Eteno
Como há 200 gramas das duas moléculas (eteno e etano) na mistura, considera-se que há 60 gramas de etano.
Faz-se então o cálculo da molaridade do etano:
M = m/MM.V(L)
M = 60g/30g.mol-1.10L
M = 0,2 mol.L-1
Leia mais em Brainly.com.br - https://brainly.com.br/tarefa/12761410#readmore
Tanto o etano quanto o eteno pesam 28g/mol, o que os diferem é a lig dupla, sendo assim,
o Br2 = 160g
eteno + Br2 = 188g/mol
1,2 -dibromoetano
188g ----------------------------------1mol
940g ---------------------------------- x mols
x = 940/188 = 5 mols
Ou seja o havia no cilindro 5 (mols) * 28g (eteno) = 160g/mol,
Se haviam 200g (total) - 140g (eteno) = 60g de etano
Logo,
etano
28g ------------- 1 mol
60g ------------- x mols
x = 60/28 ≅ 2 mols
[etano] = 2mols/10L = 0,2 mols/L
C=M/MM*V
C=200g/940*10L
C=200/9400
Cmolar=0,2
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo