Dadas as entalpias de formação dos compostos:CO2(g) Δ...
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJDadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O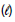 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,