A tabela mostra valores do pH da água líquida em diferentes ...
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
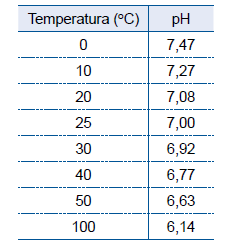
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por:
- Gabarito Comentado (1)
- Aulas (12)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Gabarito do Professor: Letra A.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Autor: Talita Goulart , Graduação e Mestrado em Engenharia Química pela UFRRJ, Doutoranda em Engenharia Química pela COPPE/UFRJ, Professora de Química. , de Química
H2O(l) ⇋ H+(aq) + OH-(aq)
Dessa forma, a água se ioniza formando íons H+ e OH-. De acordo com a análise da tabela, conforme a temperatura aumenta ocorre uma diminuição no valor do pH, que pode ser definido pela seguinte fórmula:
pH = -log [H+]
Sendo assim, quanto menor o pH, maior o valor da concentração de íons H+. A constante que representa o equilíbrio envolvido no processo de autoionização é chamada de produto iônico da água (Kw) e é dada pela seguinte fórmula:
Kw = [H+] ∙ [OH-]
Nesse sentido, observando a fórmula acima, percebe-se que quanto maior a quantidade de íons H+, maior o valor de Kw. Como a autoionização da água, ou seja, a formação dos íons H+ e OH- é favorecida pelo aumento da temperatura, uma vez que a concentração de íons H+ aumenta, isso significa que a reação absorve energia para acontecer, sendo classificada como um processo endotérmico.
Portanto, a análise desses dados permite afirmar que o produto iônico da água, Kw, aumenta com a elevação da temperatura e que a reação de autoionização da água absorve energia, sendo, portanto, um processo endotérmico.
Gabarito do Professor: Letra A.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo
