Existem quatro números quânticos: número quântico principal...
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
- Gabarito Comentado (1)
- Aulas (5)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Como descrito no enunciado, existem quatro números quânticos que podem descrever os elétrons nos átomos:
● número quântico principal (n) - especifica o nível de energia ou “camada" que o elétron ocupa:
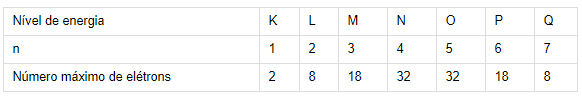
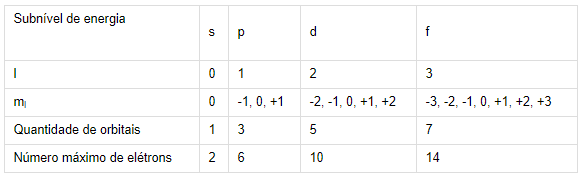
Com base no exposto, observemos a análise das alternativas:
A) ERRADA – n = 4, l = 4, ml = 3, ms = + ½
Não existe l = 4, ele só assume valores até 3, como mostrado na segunda tabela acima, pois só existem 4 subníveis de energia (s, p, d e f) e o valor de l começa no 0.
Dessa forma, essa não é uma descrição correta para um elétron de determinado átomo.
B) ERRADA – n = 3, l = 2, ml = - 3, ms = - ½
C) ERRADA – n = 0, l = 0, ml = 0, ms = + ½
D) CORRETA – n = 3, l = 1, ml = 0, ms = - ½
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Alternativa A: impossível, pois os valores possíveis de l são 0, 1, 2 e 3 (ou s, p, d, f).
Alternativa B: impossível, pois para o valor de l = 2 os valores possíveis de ml são -2, -1, 0, 1 e 2.
Alternativa C: impossível, pois n pode assumir valores de 1 a 7 (ou K, L, M, N, O, P, Q).
Alternativa D: possível.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo