Titularam-se 20.00 mL de uma solução de HCl 0.1000 M com um...
Próximas questões
Com base no mesmo assunto
Ano: 2016
Banca:
CECIERJ
Órgão:
CEDERJ
Prova:
CECIERJ - 2016 - CEDERJ - Vestibular - Segundo Semestre |
Q648417
Química
Titularam-se 20.00 mL de uma solução de HCl
0.1000 M com uma solução de NaOH 0.1000 M.
O valor de pH quando o volume titulante adicionado for 1.00% maior do que o volume necessário para que o ponto de equivalência seja alcançado é
O valor de pH quando o volume titulante adicionado for 1.00% maior do que o volume necessário para que o ponto de equivalência seja alcançado é
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Esta questão envolve conceitos de
titulometria. Dessa forma, é importante saber que numa titulação, a
concentração de um composto ou solução desconhecidos é determinada por meio de
outra solução com concentração conhecida. O ponto de equivalência é o momento
em que o titulante (solução de concentração conhecida) reage completamente com
o titulado (solução de concentração desconhecida), ou seja, o volume exato do
titulante necessário para que a reação aconteça completamente. Com base nesses
conceitos, observemos os dados fornecidos e a resolução:
Dados:
V (HCl) = 20,00 mL = 0,02 L
M (HCl) = 0,1 mol/L
M (NaOH) = 0,1 mol/L
Resolução:
Essa questão descreve uma titulação
ácido-base em que o HCl é titulado pelo NaOH, em que acontece a seguinte
reação:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O
(l)1) Pela reação é possível perceber que
1 mol de NaOH reage com 1 mol de HCl, logo, o número de mols de NaOH e HCl para
que a reação aconteça de forma completa são iguais:
n (NaOH) = n (HCl)M (NaOH) ∙ V (NaOH) = M (HCl) ∙ V (HCl)
Dessa forma:
0,1 ∙ V (NaOH) = 0,1 ∙ 0,02
V (NaOH) = 0,02 L
2) O volume de NaOH necessário para
atingir o ponto de equivalência é igual a 0,02 L, entretanto, o enunciado pede
o pH quando o volume é 1,00% maior que o necessário para atingir o ponto de
equivalência (Vreal (NaOH)). Logo:
Vreal (NaOH) = 0,02 + 1/100 ∙ 0,02
= 0,0202 L3) Como foi utilizado um volume maior que
o necessário para atingir o ponto de equivalência, a partir do momento em que
esse ponto é alcançado não há mais ácido na solução, pois o HCl reagiu
completamente com o NaOH. Dessa forma, o pH é determinado pela concentração de
OH- proveniente do NaOH adicionado em excesso:
n (NaOH) = 0,0202 ∙ 0,1 = 0,00202 molsn (HCl) = 0,002 ∙ 0,1 = 0,002 mols
De acordo com a reação:
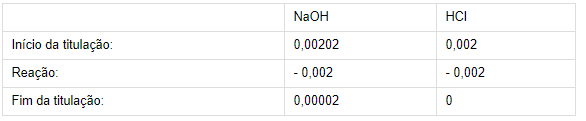
Logo, ao final da titulação há 0,0002 mols de NaOH.
4) A partir do número de mols final de NaOH é possível calcular a concentração de OH-:
[OH-] = nfinal (NaOH) / Vtotal = 0,00002/0,0402 ≅ 4,98 x 10-4 mol/L
pOH = - log [OH-] = -log (4,98 x 10-4) = - [log (4,98) + log (10-4)] = - (0,7 - 4) = 3,30
5) Por fim, calcula-se o pH:
pH + pOH = 14
pH = 14 - 3,3 = 10,70
Gabarito do professor: Letra C.
Dica: como é difícil saber o log de
números como 4,98 sem o uso da calculadora, é possível supor o valor final do
pH pelo log de 10-4, que é igual ao expoente da base 10, - 4. Dessa forma, como o log de
4,98 com certeza é < 1,0, pode-se perceber que o valor do pOH será um pouco
menor que 4, e, portanto, o pH será próximo de 10, o que nos leva à alternativa
C.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo