A ureia reage com a amônia líquida, formando um sal de amôni...
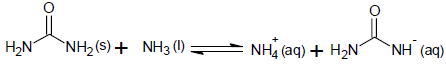
Sobre a natureza das interações entre as espécies envolvidas na reação, o comportamento químico das substâncias reagentes e o átomo de nitrogênio, é correto afirmar:
Comentários
Veja os comentários dos nossos alunos
Na teoria de Bronsted-Lowry, o ácido é aquele composto doador de íon H+, enquanto a base é o composto receptor desse íon. Perceba, portanto, que, em uma reação química, sempre haverá um ácido e uma base.
Por uma simples análise da reação química, é notável que o NH3 recebe H+, formando o íon amônio (NH4+), enquanto a ureia doa H+ (perceptível pela carga negativa assumida em sua forma iônica, à direita da reação). Desse modo NH3 atua como base e ureia como ácido, de acordo com essa teoria. É importante ressaltar, também, que todo ácido de Bronsted tem uma base conjugada, assim como toda base de Bronsted tem um ácido conjugado. Nesse caso, o ácido conjugado da base NH3 é o íon NH4+ e a base conjugada do ácido ureia é o ânion à direita da reação.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo