Uma das etapas do tratamento de água para a rede de distribu...
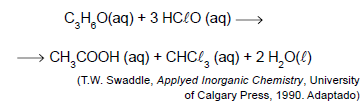
Considerando-se o tratamento de 1 m3 de água contaminada com acetona na concentração 5,8 mg/L, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a
- Gabarito Comentado (1)
- Aulas (8)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Dados:
V (água contaminada) = 1m3;
Concentração de acetona na água = 5,8 mg/L;
Massas molares (fornecidas pela tabela periódica, g/mol): C = 12; H = 1; O = 16.
Resolução:
1) Para calcular a quantidade máxima de ácido hipocloroso (HClO) consumida é preciso saber quantos mols de acetona (C3H6O) estão presentes na água. A massa (m) de acetona, em gramas, pode ser obtida multiplicando a concentração (C) pelo volume (V), sendo que 1 m3 é igual a 1000 L e 1 g possui 1000 mg:
m (C3H6O) = C (C3H6O) ∙ V (água)
m (C3H6O) = 5,8 × 1000 = 5800 mg = 5800/1000 g = 5,8 g
2) Para saber quantos mols há em 5,8 g de C3H6O basta utilizar a massa molar e realizar uma regra de três:
MM (C3H6O) = 3 × 12 + 6 × 1 + 16 = 58 g/mol
1 mol de C3H6O possui 58 g
X -------- 5,8
X = 5,8/58 = 0,1 mols de C3H6O
3) A partir da quantidade em mols de C3H6O presente na água é possível saber quantos mols de HClO podem ser consumidos por essa acetona, utilizando a reação:
C3H6O(aq) + 3 HClO(aq) → CH3COOH(aq) + CHCl3(aq) + 2 H2O(l)
Como a reação já está balanceada, 1 mol de C3H6O reage com 3 mols de HClO, logo:
1 mol de C3H6O reage com 3 mols de HClO
0,1 -------- Y
Y = 0,1 × 3 = 0,3 = 3,0 × 10–1 mols de HClO
Portanto, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a 3,0 × 10–1.
Gabarito do Professor: Letra C.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Dados:
V (água contaminada) = 1m3;
Concentração de acetona na água = 5,8 mg/L;
Massas molares (fornecidas pela tabela periódica, g/mol): C = 12; H = 1; O = 16.
Resolução:
1) Para calcular a quantidade máxima de ácido hipocloroso (HClO) consumida é preciso saber quantos mols de acetona (C3H6O) estão presentes na água. A massa (m) de acetona, em gramas, pode ser obtida multiplicando a concentração (C) pelo volume (V), sendo que 1 m3 é igual a 1000 L e 1 g possui 1000 mg:
m (C3H6O) = C (C3H6O) ∙ V (água)
m (C3H6O) = 5,8 × 1000 = 5800 mg = 5800/1000 g = 5,8 g
2) Para saber quantos mols há em 5,8 g de C3H6O basta utilizar a massa molar e realizar uma regra de três:
MM (C3H6O) = 3 × 12 + 6 × 1 + 16 = 58 g/mol
1 mol de C3H6O possui 58 g
X -------- 5,8
X = 5,8/58 = 0,1 mols de C3H6O
3) A partir da quantidade em mols de C3H6O presente na água é possível saber quantos mols de HClO podem ser consumidos por essa acetona, utilizando a reação:
C3H6O(aq) + 3 HClO(aq) → CH3COOH(aq) + CHCl3(aq) + 2 H2O(l)
Como a reação já está balanceada, 1 mol de C3H6O reage com 3 mols de HClO, logo:
1 mol de C3H6O reage com 3 mols de HClO
0,1 -------- Y
Y = 0,1 × 3 = 0,3 = 3,0 × 10–1 mols de HClO
Portanto, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a 3,0 × 10–1.
Gabarito do Professor: Letra C.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo