Em uma aula de laboratório de química, foi realizado um expe...
Próximas questões
Com base no mesmo assunto
Ano: 2018
Banca:
VUNESP
Órgão:
INSPER
Prova:
VUNESP - 2018 - INSPER - Engenharias - Ciências da Natureza |
Q1338083
Química
Em uma aula de laboratório de química, foi realizado um experimento que consistiu em adicionar em um béquer 300 g
de água, em temperatura ambiente, e certa quantidade do
sal sulfato de magnésio hexaidratado (MgSO4 .6H2O) até formar uma solução saturada com corpo de fundo. Essa mistura
foi aquecida até completa solubilização do sal, que ocorreu
quando a temperatura atingiu 50 ºC. Na sequência, deixou-
-se a solução resfriar até 20 ºC e verificou-se novamente a
presença do sal cristalizado no fundo do béquer.
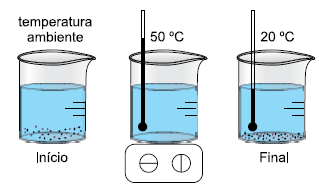
Foram fornecidos aos alunos os dados de solubilidade desse sal nas duas temperaturas medidas.

Com as informações fornecidas, foram calculadas as massas do sal presente na solução a 50ºC e do sal cristalizado a 20ºC. Esses resultados são corretamente apresentados, nessa ordem, em:

Foram fornecidos aos alunos os dados de solubilidade desse sal nas duas temperaturas medidas.

Com as informações fornecidas, foram calculadas as massas do sal presente na solução a 50ºC e do sal cristalizado a 20ºC. Esses resultados são corretamente apresentados, nessa ordem, em:
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Esta questão aborda conceitos relacionados à solubilidade de sais. No início do experimento foi formada uma solução saturada do sal MgSO4.6H2O com corpo de fundo, ou seja, o coeficiente de solubilidade (capacidade máxima de solubilização em um solvente) foi atingido. O sal foi completamente solubilizado em 50 °C e, após o resfriamento, até 20 °C, a solução voltou a apresentar corpo de fundo devido à cristalização do sal. Sendo assim, observemos os dados e a resolução da questão:
Dados:
Coeficiente de solubilidade (massa do soluto em 100 g de H2O): 44,5 g (à 20 °C) e 53,5 g (à 50 °C);
Massa de H2O = 300 g.Resolução:
Para saber a massa de sal presente na solução a 50 °C basta realizar uma regra de três, considerando que o sal foi totalmente solubilizado:
53,5 g de sal a cada 100 g
Y -------- 300
Y = 300 ∙ 53,5/100 = 3 ∙ 53,5 = 160,5 g de sal presente na solução
Para saber a massa de sal cristalizado a 20 °C é preciso saber o quanto de sal foi solubilizado:
44,5 g de sal a cada 100 g
X --------- 300
X = 300 ∙ 44,5/100 = 3 ∙ 44,5 = 133,5 g de sal solubilizado
A massa de sal cristalizado a 20 °C é a quantidade de sal que não solubilizou após o coeficiente de solubilidade ter sido atingido, logo, ela pode ser dada pela diferença entre a quantidade total (que foi solubilizada a 50 °C) menos a quantidade solubilizada a 20 °C:
Para saber a massa de sal presente na solução a 50 °C basta realizar uma regra de três, considerando que o sal foi totalmente solubilizado:
53,5 g de sal a cada 100 g
Y -------- 300
Y = 300 ∙ 53,5/100 = 3 ∙ 53,5 = 160,5 g de sal presente na solução
Para saber a massa de sal cristalizado a 20 °C é preciso saber o quanto de sal foi solubilizado:
44,5 g de sal a cada 100 g
X --------- 300
X = 300 ∙ 44,5/100 = 3 ∙ 44,5 = 133,5 g de sal solubilizado
A massa de sal cristalizado a 20 °C é a quantidade de sal que não solubilizou após o coeficiente de solubilidade ter sido atingido, logo, ela pode ser dada pela diferença entre a quantidade total (que foi solubilizada a 50 °C) menos a quantidade solubilizada a 20 °C:
massa de sal cristalizado = 160,5 - 133,5 = 27,0 g
Gabarito do Professor: Letra E.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo