O “besouro bombardeiro” espanta seus predadores, expelindo ...
C6H4(OH)2(aq) + H2O2
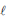 ) hidroquinona
) hidroquinona O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔHº = + 177 kJ . mol-1
H2O (
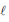 ) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
H2O(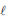 ) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1