A figura representa uma amostra de um gás, suposto ideal, co...
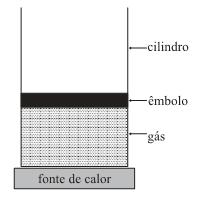
Considere duas situações:
I. o êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante;
II. o êmbolo é fixo, mantendo o gás a volume constante. Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
Comentários
Veja os comentários dos nossos alunos
Situações:
1) pressão constante:
W= p . (vf - vi)
Logo temos trabalho, pois houve variação do volume.
2) volume constante, não temos trabalho.
U= Q - 0
1) Temos trabalho: U1= Q - W
2) Não temos trabalho: U2= Q
U2 > U1
logo a temperatura será maior em 2 do que em 1.
Para resolver essa questão, precisamos entender o comportamento de um gás ideal sob diferentes condições, de acordo com a Primeira Lei da Termodinâmica, que pode ser expressa como:
Q=ΔU+WQ = \Delta U + WQ=ΔU+W
Onde:
- QQQ é o calor fornecido ao sistema;
- ΔU\Delta UΔU é a variação da energia interna do gás;
- WWW é o trabalho realizado pelo gás.
Vamos analisar as duas situações descritas:
Situação I: O êmbolo pode mover-se livremente (pressão constante)
Neste caso, como o êmbolo pode se mover, o gás pode se expandir, realizando trabalho sobre o êmbolo. Assim, o calor QQQ fornecido ao sistema será usado tanto para aumentar a energia interna (ΔU\Delta UΔU) do gás quanto para realizar trabalho (WWW) sobre o êmbolo.
Q=ΔU+WQ = \Delta U + WQ=ΔU+W
Situação II: O êmbolo é fixo (volume constante)
Nesta situação, o volume do gás não muda, então o gás não realiza trabalho (W=0W = 0W=0). Todo o calor QQQ fornecido ao sistema é usado para aumentar a energia interna (ΔU\Delta UΔU) do gás.
Q=ΔUQ = \Delta UQ=ΔU
Comparação das duas situações:
Como em ambas as situações é fornecida a mesma quantidade de calor, QQQ, e em I parte desse calor é usado para realizar trabalho, a variação da energia interna (ΔU\Delta UΔU), que é proporcional ao aumento de temperatura, será maior na situação II (volume constante).
Logo, a temperatura do gás aumenta mais na situação II do que na situação I.
Resposta correta: C (mais em II do que em I).
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo