Um professor de química, em uma aula sobre ácidos e determi...
Concentração de ácido acético: 6,0% m/V
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?” As seguintes informações foram fornecidas pelo professor:
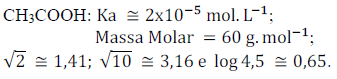
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
Comentários
Veja os comentários dos nossos alunos
6% m/v significa que tem 6 gramas a cada 100 ml. Para achar a concentração em mol/L iremos fazer uma regra de 3.
6 g -------------> 100 ml
X ---------------> 1000 ml
X= 60 g
1 Mol de acido acético (H3CCOOH) tem massa molar igual a 60 gramas. Logo, 6 % se trata de 1 mol de acido acético.
O acido acético se decompõe da seguinte forma:
H3CCOOH ---> H3COO- + H+
1 MOL -------> 1 MOL + 1 MOL
Ka= [ H3CCOO-] . [H+] / [H3CCOOH]
Temos o valor de Ka = 2. 10^-5 e temos o valor da concentração do acido acético [H3CCOOH] = 1 mol/L
COMO NÃO SABEMOS O VALOR DA CONCENTRAÇÃO DO ACETATO E DO H+, IREMOS CHAMAR DE " X ", POIS A RELAÇÃO ESTÁ DE 1 PARA 1
Agr é só substituir
2. 10^-5 = X . X / 1
X^2 = 2. 10^-5
PRA FICAR MAIS FÁCIL IREMOS FAZER O SEGUINTE
X^2= 20. 10^-6
X= RAIZ QUADRADA DE 20.10^-6
X= RAIZ QUADRADA DE 2. 10 . 10^-6
X= 1,41 . 3,16 . 10^-3
X= 4,45 . 10^-3
ARREDONDAREMOS, POIS FOI DADO O LOG DE 4,5
X É APROXIMADAMENTE = 4,5 . 10^-3
H3CCOOH ---> H3COO- + H+
1 MOL -------> 1 MOL + 1 MOL
COMO A REALAÇÃO É DE 1 MOL PRA CADA, PODEMOS DIZER QUE [H+] É IGUAL A 4,5 . 10^-3
Pontanto, PH = - Log [H+]
PH = - Log 4,5 . 10^-3
PH = - (0,65 - 3)
PH = 2,35
COMO PEDIU O PH MAIS PRÓXIMO
PH = 2,4
GABARITO LETRA C
ESPERO TER AJUDADO!
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo