Questões de Vestibular
Foram encontradas 699 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
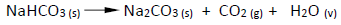
A termólise de 84 g do reagente produzirá a massa de carbonato de sódio e o número de mols de dióxido de carbono iguais a, respectivamente,
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
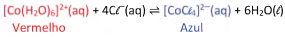
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
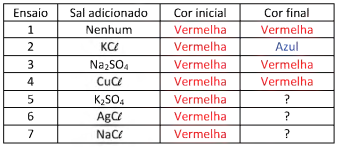
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
PbCO3(s) ⥋ Pb2 +(aq) + CO3 2 –(aq)
A concentração de íons carbonato, presentes nesse equilíbrio, é
Dado: Produto de Solubilidade do PbCO3, a 25 °C: Kps = 7,4 · 10–14
Dados: Volume Molar (CATP) = 25 L; d(C8H18) = 800 g/L; Massas Molares – H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Al + Fe2O3 → Fe + Al2O3
Dados: Massas Molares – O = 16 g/mol; Al = 27 g/mol; Fe = 56 g/mol