Questões de Vestibular
Foram encontradas 496 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
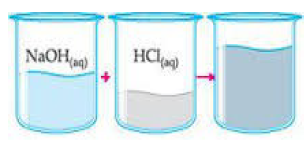
Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação
Equações:
I) NaOH + CH3COOH → CH3COONa + H2O II) Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O III) NH4OH + HCl → NH4Cl + H2O
O papel tornassol ficará azul em contato com a solução resultante, na/nas reação/reações:
A partir da análise dessas informações, é correto afirmar:
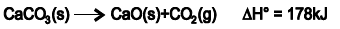
O calcário formado principalmente por carbonato de cálcio, CaCO3 (s), é um mineral importante na correção da acidez do solo, na produção de cimento e de óxido de cálcio CaO, conhecido como cal.
O Brasil utiliza cerca de um milhão de toneladas de óxido de cálcio por ano. A partir da decomposição térmica do carbonato de cálcio representada pela equação química, é correto afirmar:
