Questões do Enem
Sobre equilíbrio químico em química
Foram encontradas 51 questões
Diversos produtos naturais podem ser obtidos de plantas por processo de extração. O lapachol é da classe das naftoquinonas. Sua estrutura apresenta uma hidroxila enólica (pKa = 6,0) que permite que este composto seja isolado da serragem dos ipês por extração com solução adequada, seguida de filtração simples. Considere que pKa = -log Ka, em que Ka é a constante ácida da reação de ionização do lapachol.
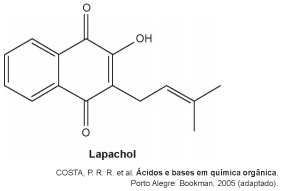
Qual solução deve ser usada para extração do lapachol
da serragem do ipê com maior eficiência?
As águas dos oceanos apresentam uma alta concentração de íons e pH entre 8,0 e 8,3. Dentre esses íons estão em equilíbrio as espécies carbonato (CO32-) e bicarbonato (HCO3-), representado pela equação química:
HCO3-(aq) ⇌ CO32-(aq) + H+(aq)
As águas dos rios, ao contrário, apresentam concentrações muito baixas de íons e substâncias básicas, com um pH em torno de 6. A alteração significativa do pH das águas dos rios e oceanos pode mudar suas composições químicas, por precipitação de espécies dissolvidas ou redissolução de espécies presentes nos sólidos suspensos ou nos sedimentos.
A composição dos oceanos é menos afetada pelo lançamento de efluentes ácidos, pois os oceanos
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
Os métodos empregados nas análises químicas são ferramentas importantes para se conhecer a composição dos diversos materiais presentes no meio ambiente. É comum, na análise de metais presentes em amostras ambientais, como água de rio ou de mar, a adição de um ácido mineral forte, normalmente o ácido nítrico (HNO3), com a finalidade de impedir a precipitação de compostos pouco solúveis desses metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise pode ser subestimado, porque
Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.
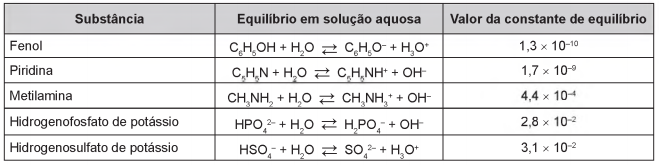
Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCI e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4 sobre o filtrado e observa-se por 30 min.
TUBINO, M.; SIMONI, J. A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
Cinco indústrias de ramos diferentes foram instaladas ao longo do curso de um rio. O descarte dos efluentes dessas indústrias acarreta impacto na qualidade de suas águas. O pH foi determinado em diferentes pontos desse rio, a 25 °C, e os resultados são apresentados no quadro.
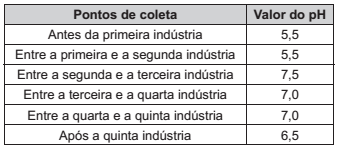
A indústria que descarta um efluente com características básicas é a
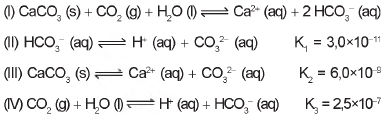
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 “C, qual é o valor numérico da constante de equilíbrio da reação I?
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)

A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
Fertilizantes químicos mistos, denominados NPK, são utilizados para aumentar a produtividade agrícola, por fornecerem os nutrientes nitrogênio, fósforo e potássio, necessários para o desenvolvimento das plantas. A quantidade de cada nutriente varia de acordo com a finalidade do adubo. Um determinado adubo NPK possui, em sua composição, as seguintes substâncias: nitrato de amônio (NH4NO3), ureia (CO(NH2)2) nitrato de potássio (KNO3), fosfato de sódio (Na3PO4) e 'cloreto de potássio (KCl).
A adição do adubo descrito provocou diminuição no pH de um solo. Considerando o caráter ácido/básico das substâncias constituintes desse adubo, a diminuição do pH do solo deve ser atribuída à presença, no adubo, de uma quantidade significativa de
A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de água rica em C 02 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e HCO3-. Numa segunda etapa, a solução aquosa desses íons chega a uma caverna e ocorre a reação inversa, promovendo a liberação de CO2 e a deposição de CaCO3, de acordo com a equação apresentada.
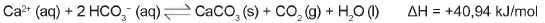
Considerando o equilíbrio que ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a)
A tabela lista os valores de pH de algumas bebidas consumidas pela população.

Ca5(PO4)3OH (s)
 5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq) Das bebidas listadas na tabela, aquela com menor potencial de desmineralização dos dentes é o
A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde Ca(OH)2 em excesso e AI2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas. Após decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, Al, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de AI2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3 000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio (NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H2O), produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial, produzindo bicarbonato de sódio (NaHCO3):
CO2 + H2O → H2CO3
H2CO3 + NaOH → NaHCO3 + H2O
ARROIO, A. et al. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
Cl2 (g) + 2 H2O ( l ) ⥨ HCIO (aq) + H3O+ (aq) + Cl (aq)
HCIO (aq) + H2O (I) ⥨ H3O+ (aq) + CIO- (aq) pKa = - log Ka = 7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
4 FeS2 (s) + 15O2 (g) + 2 H2O (I) ➙ 2 Fe2(SO4)3 (aq) + 2 H2 SO4 (aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
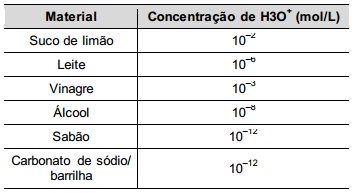
Dentre os materiais listados, quais são apropriados para amenizar esse odor?