Questões do Enem
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 62 questões
Considere as massas molares: NaCl = 58,5 g/mol; Na = 23 g/mol.
Qual é o valor mais próximo da massa, em grama, de cloreto de sódio presente em uma única colher pequena?
Do ponto de vista da química, a que se deve essa variação de volume?
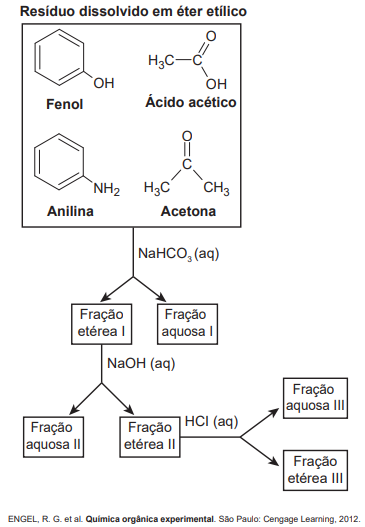
Os componentes do resíduo que estão presentes nas frações aquosas II e III são, respectivamente,
I – KCl II – MgO III – NH4 Br IV – AlCl3 V – P2 O5
Para a correção do pH desse solo, o agricultor deverá utilizar a espécie química indicada pelo número
bula de um determinado medicamento traz as seguintes informações:

De acordo com as informações apresentadas na bula,
a substância que se encontra em maior concentração
e a não condutora de corrente elétrica, quando em
solução aquosa, são, respectivamente,
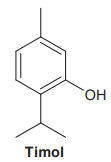
A dissolução desse composto em uma solução de hidróxido de sódio se deve ao(à)
Hg2(NO3 )2 (aq) + 2 NaCl (aq) ➝ Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
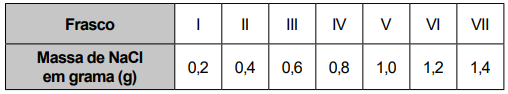
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2 (NO3 )2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg2Cl2 é 472 g mol–1.
Qual foi o gráfico obtido pelo assistente de laboratório?
Atualização da recomendação da Sociedade Portuguesa de Neonatologia. Disponível em: www.spneonatologia.pt. Acesso em: 22 out. 2021 (adaptado).
Caso esse suplemento seja acondicionado em embalagem desse tipo de vidro, o risco de contaminação por alumínio será maior se o(a)
Considere a massa molar da água igual a 18 g mol−1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol−1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol L-1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação é representada pela equação química:
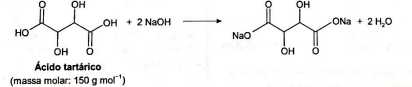
A concentração de ácido tartárico no vinho analisado é mais próxima de:
O etanol é um combustível produzido a partir da fermentação da sacarose presente no caldo de cana-de-açúcar. Um dos fatores que afeta a produção desse álcool é o grau de deterioração da sacarose, que se inicia após o corte, por causa da ação de microrganismos. Foram analisadas cinco amostras de diferentes tipos de cana-de-açúcar e cada uma recebeu um código de identificação. No quadro são apresentados os dados de concentração de sacarose e de microrganismos presentes nessas amostras.
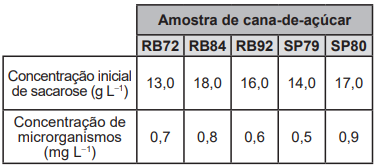
Pretende-se escolher o tipo de cana-de-açúcar que conterá o maior teor de sacarose 10 horas após o corte e que, consequentemente, produzirá a maior quantidade de etanol por fermentação. Considere que existe uma redução de aproximadamente 50% da concentração de sacarose nesse tempo, para cada 1,0mgL-1 de microrganismos presentes na cana-de-açúcar.
Disponível em: www.inovacao.unicamp.br. Acesso em: 11 ago. 2012 (adaptado)
Qual tipo de cana-de-açúcar deve ser escolhido?
Os riscos apresentados pelos produtos dependem de suas propriedades e da reatividade quando em contato com outras substâncias. Para prevenir os riscos devido à natureza química dos produtos, devemos conhecer a lista de substâncias incompatíveis e de uso cotidiano em fábricas, hospitais e laboratórios, a fim de observar cuidados na estocagem, manipulação e descarte. O quadro elenca algumas dessas incompatibilidades, que podem levar à ocorrência de acidentes.
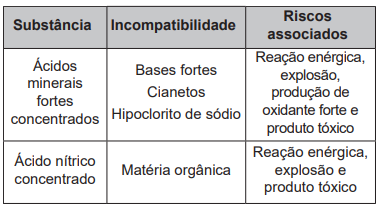
Considere que houve o descarte indevido de dois conjuntos de substâncias:
(1) ácido clorídrico concentrado com Cianeto de potássio;
(2) ácido nítrico concentrado com sacarose.
Disponível em: www.fiocruz.br. Acesso em: 6 dez 2017 (adaptado).
O descarte dos conjuntos (1) e (2) resultará, respectivamente, em
Um grupo de alunos realizou um experimento para observar algumas propriedades dos ácidos, adicionando um pedaço de mármore (CaCO3) a uma solução aquosa de ácido clorídrico (HCl), observando a liberação de um gás e o aumento da temperatura.
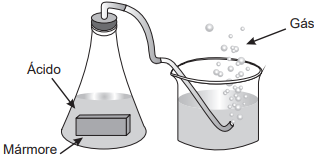
O gás obtido no experimento é o:
Uma antiga forma de produzir um dos constituintes de argamassas é o aquecimento a altas temperaturas de materiais componentes dos sambaquis, que são sítios arqueológicos formados essencialmente por restos de moluscos. A decomposição térmica da principal substância desses sítios arqueológicos resulta na formação de dois compostos apenas. Um deles é um óxido sólido e o outro é um óxido gasoso. A reação do primeiro com água resulta na formação de Ca(OH)2 (aquoso), enquanto a reação do segundo resulta em H2CO3 (aquoso).
A fórmula da principal substância encontrada nesses sítios arqueológicos é:
O ácido sulfúrico (H2SO4 ) é um dos ácidos mais utilizados em indústrias e em laboratórios. O resíduo ácido gerado pelo seu uso pode provocar sérios danos ao meio ambiente. Em um laboratório, gerou-se uma grande quantidade de resíduo ácido a partir do ácido sulfúrico, o qual necessita ser neutralizado para o seu descarte. O técnico desse laboratório tem à sua disposição cinco substâncias: CaO, K2SO4 , NaHSO4 , CH3CH2OH e C5H9CONH2 .
Qual dessas substâncias é a adequada para realizar esse tratamento?
Um produto, obtido industrialmente da eletrólise de solução aquosa de cloreto de sódio, tem sido amplamente empregado na indústria, por exemplo, na fabricação de papéis, tecidos e sabões. Normalmente, esse produto é usado na desobstrução de encanamentos e sumidouros, pois é capaz de reagir com gorduras. No entanto, a sua manipulação exige cuidados, pois é altamente corrosivo, podendo, em contato com a pele, provocar vermelhidão, irritação ou “queimaduras” de tecidos vivos. Além disso, se o frasco do produto for abandonado aberto por um longo período de tempo, ele pode absorver CO2, convertendo-se em um sal.
Esse produto industrial é o
O solvente tetracloroeteno ou percloroetileno é largamente utilizado na indústria de lavagem a seco e em diversas outras indústrias, tais como a de fabricação de gases refrigerantes. Os vapores desse solvente, quando expostos à elevada temperatura na presença de oxigênio e água, sofrem degradação produzindo gases poluentes, conforme representado pela equação:
C2Cl4 (g)+O2 (g)+H2O(g) → 2HCl(g)+Cl2 (g)+CO(g)+CO2 (g)
BORGES, L. D.; MACHADO, P. F. L. Lavagem a seco. Química Nova na Escola,
n. 1, fev. 2013 (adaptado).
Os produtos dessa degradação, quando lançados no
meio ambiente, contribuem para a

 LENZI, E.; FAVERO, L. O. B.; LUCHESE, E. B. Introdução à química da água: ciência, vida e sobrevivência.
Rio de Janeiro: LTC, 2012 (adaptado).
LENZI, E.; FAVERO, L. O. B.; LUCHESE, E. B. Introdução à química da água: ciência, vida e sobrevivência.
Rio de Janeiro: LTC, 2012 (adaptado).
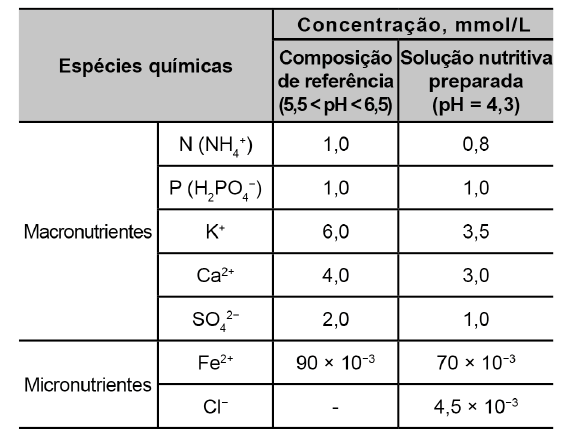
Para correção do pH da solução nutritiva preparada, esse produtor pode empregar uma solução de
O íon que vai produzir o efeito desejado de correção no valor do pH é o