Questões do Enem
Sobre transformações químicas e energia em química
Foram encontradas 73 questões

NAM, D.-H.; CHOI, K.-S. Bismuth as a New Chloride-Storage Electrode Enabling the Construction of a Practical High Capacity Desalination Battery. Journal of the American Chemical Society, n. 139, 2017 (adaptado).
Durante a dessalinização da água por eletrólise ocorre a formação de

CH3COO− (aq) + 2 H2O (I) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (I)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
O quadro apresenta as entalpias de combustão de alguns combustíveis nas condições padrão.
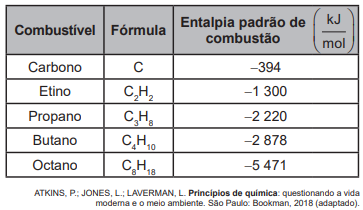
Visando a redução do impacto ambiental, qual dos combustíveis listados libera maior quantidade de energia com menor produção de CO2 ?
A figura ilustra de solos esquematicamente um processo de remediação de solos contaminados com tricloroeteno (TCE), um agente desengraxante. Em razão de vazamentos de tanques de estocagem ou de manejo inapropriado de resíduos industriais, ele se encontra presente em águas subterrâneas, nas quais forma uma fase líquida densa não aquosa (DNAPL) que se deposita no fundo do aquífero. Essa tecnologia de descontaminação emprega o Íon persulfato (S2O82-), que é convertido no radical •SO4- por minerais que contêm Fe(Ill). O esquema representa de forma simplificada o mecanismo de ação química sobre o TCE e a formação dos produtos de degradação.
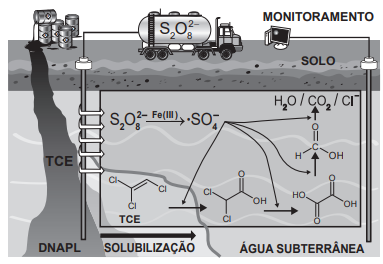
Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
O elemento iodo (I) tem função biológica e é acumulado na tireoide. Nos acidentes nucleares de Chernobyl e Fukushima, ocorreu a liberação para a atmosfera do radioisótopo 131I, responsável por enfermidades nas pessoas que foram expostas a ele. O decaimento de uma massa de 12 microgramas do isótopo 131I foi monitorado por 14 dias, conforme o quadro.
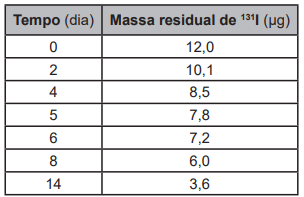
Após o período de 40 dias, a massa residual desse
isótopo é mais próxima de
A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4Fe(s) + 2H2O(I) + 3O2(g) → 2 Fe2O3 ˑ H2O (s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (AL2O3) sobre a superficie do objeto que se deseja proteger.
CLEMENTE. G. A. B. F. et al. O uso de matenais hibridos ou nanocompósitos como revestimentos anticorrosivos do aço. Quimica Nova, n. 9, 2021 (adaplado).
Essa nanotecnologia aplicada na proteção contra a
corrosão se baseia no(a)
Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação de entalpia menor que zero (∆H < 0). Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
O gráfico que esboça a variação da energia potencial no
progresso da reação é representado por:
Alguns recipientes de cozinha apresentam condutividade térmica apropriada para acondicionar e servir alimentos. Assim, os alimentos acondicionados podem manter a temperatura, após o preparo, por um tempo maior. O quadro contém a condutividade térmica (k) de diferentes materiais utilizados na produção desses recipientes.
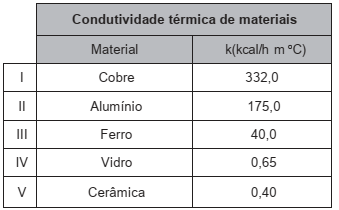
Considerando recipientes de mesma espessura, qual o
material recomendado para manter o alimento aquecido
por um maior intervalo de tempo?

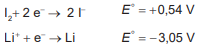
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
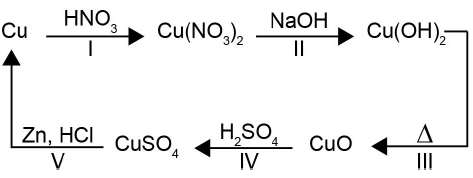
A reação de redução do cobre ocorre na etapa
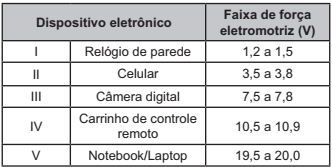

Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e- → 2 I- E° = + 0,54V
Li+ + e- → Li E° = - 3,05 V

Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
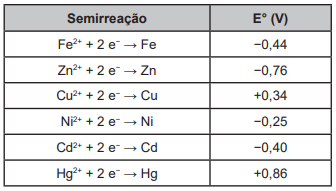
Dos metais citados, o que garantirá proteção ao tanque de aço é o
Se um núcleo de rádio-226 emitir duas partículas α, o número de massa do núcleo filho será
A explicação correta de a maresia acelerar a corrosão do aço é porque
Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
3 Ag2S (s) + 2 Al (s) + 8 NaOH (aq) → 6 Ag (s) + 3 Na2S (aq) + 2 NaAlO2 (aq) + 4 H2O (l)
A restauração do objeto de prata ocorre por causa do(a)
As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas queatuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célulaeletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve forneceruma diferença de potencial mínima para promover a recarga. Quanto maior a diferença depotencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencialpadrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço,
a diferença de potencial mínima, em volt, que ele deve superar é de
Qual é o processo envolvido na detonação dessa bomba?
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
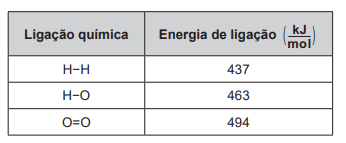
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
A propriedade que o metal associado ao cobre deve apresentar para impedir a formação de zinabre nas moedas é, em relação ao cobre,