O gás hidrogênio é considerado um ótimo combustível — o...
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
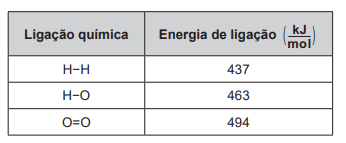
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
- Gabarito Comentado (1)
- Aulas (12)
- Comentários (14)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Questão que envolve Energia de ligação.
REAGENTE PRODUTOS
-ruptura de ligações -formação de novas ligações e novos compostos
-absorve calor-ENDO(+) -libera calor-EXO(-)
Variação de entalpia=Hreagente+Hproduto
REAG.---------------->PROD.
2.(+437) + (+494)------->2.2.(-463)
Variação de entalpia=-484 Kj\mol (EXO)
484 Kj----1 mol para reação total
484 Kj-------2 mol de H2
484 Kj-----4 g H2
Y---------1000 g (1 Kg)
Y= -121000 Kj (libera)
ΔH = Σr - Σp
exo (-) -> libera energia
endo (+) -> recebe energia
2 H2 (g) + O2 (g) → 2 H2O (g)
2 H2 = 874 (endo)
O2 = 494 (endo)
2 (2 H-O) = 1852 (exo)
cálculo: 1852 (-) 873 (-) 494 = 484
(-) 484 ------ 4g
X -------- 1 kg
X = (-) 121.000
Termoquímica -> Energia de Ligação.
Existe 3 tipos.
Energia de Calor.
Energia de Ligação
Energia de Less.
Todas caiem no enem de forma bruta.
questões que basicamente a gente chuta
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo