Questões do Enem
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 54 questões
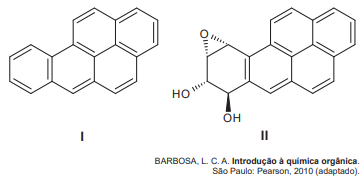
A biotransformação do composto (I) em (II) corresponde a uma reação de
Essa prática popular encontra respaldo no pensamento científico, uma vez que o doce realmente poderá azedar em razão da
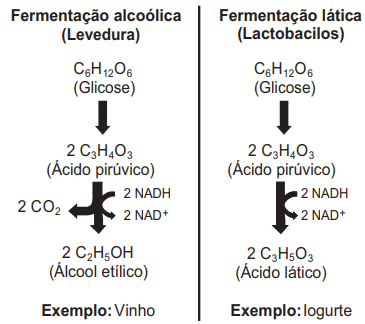
Esses processos de fermentação têm em comum a
Os riscos apresentados pelos produtos dependem de suas propriedades e da reatividade quando em contato com outras substâncias. Para prevenir os riscos devido à natureza química dos produtos, devemos conhecer a lista de substâncias incompatíveis e de uso cotidiano em fábricas, hospitais e laboratórios, a fim de observar cuidados na estocagem, manipulação e descarte. O quadro elenca algumas dessas incompatibilidades, que podem levar à ocorrência de acidentes.
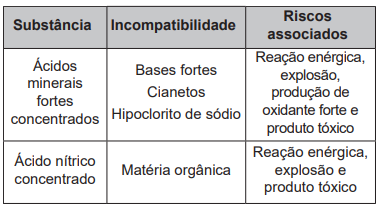
Considere que houve o descarte indevido de dois conjuntos de substâncias:
(1) ácido clorídrico concentrado com Cianeto de potássio;
(2) ácido nítrico concentrado com sacarose.
Disponível em: www.fiocruz.br. Acesso em: 6 dez 2017 (adaptado).
O descarte dos conjuntos (1) e (2) resultará, respectivamente, em
A figura ilustra de solos esquematicamente um processo de remediação de solos contaminados com tricloroeteno (TCE), um agente desengraxante. Em razão de vazamentos de tanques de estocagem ou de manejo inapropriado de resíduos industriais, ele se encontra presente em águas subterrâneas, nas quais forma uma fase líquida densa não aquosa (DNAPL) que se deposita no fundo do aquífero. Essa tecnologia de descontaminação emprega o Íon persulfato (S2O82-), que é convertido no radical •SO4- por minerais que contêm Fe(Ill). O esquema representa de forma simplificada o mecanismo de ação química sobre o TCE e a formação dos produtos de degradação.
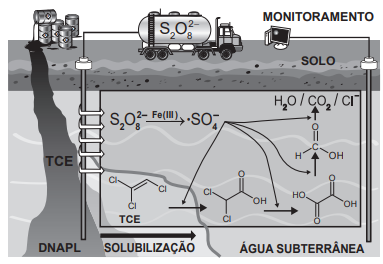
Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
Um grupo de alunos realizou um experimento para observar algumas propriedades dos ácidos, adicionando um pedaço de mármore (CaCO3) a uma solução aquosa de ácido clorídrico (HCl), observando a liberação de um gás e o aumento da temperatura.
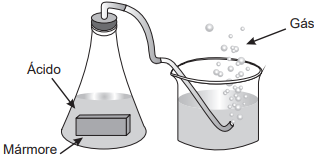
O gás obtido no experimento é o:
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
4 FeS2 (s) + 15 O2 (g) + 2 H2 O (l) → 2 Fe2 (SO4 )3 (aq) + 2 H2 SO4 (aq)
Um dos processos de intervenção nesse problema envolve a reação do resíduo ácido com uma substância básica, de baixa solubilidade em meio aquoso, e sem a geração de subprodutos danosos ao meio ambiente.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000.
Esse processo de intervenção é representado pela equação química:
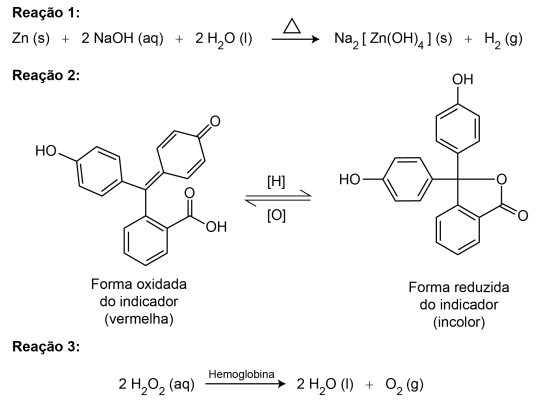
DIAS FILHO, C. R.; ANTEDOMENICO, E. A perícia criminal e a interdisciplinaridade no ensino de ciências naturais. Química Nova na Escola, n. 2, maio 2010 (adaptado).
A mudança de coloração que indica a presença de sangue ocorre por causa da reação do indicador com o(a)
O perfil de um processo que segue todos os princípios desse ramo da química pode ser representado por:
C2H5OH (I) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas em dois veículos, um movido a etanol e outro elétrico, em um mesmo trajeto de 1.000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro. Guaratinguetá: Unesp. 2015 (adaptado).
A quantidade equivalente de etanol economizada, em quilograma, com o uso do veículo elétrico nesse trajeto, é mais próxima de
Qual é a concentração de sacarose depois de 400 minutos do início da reação de hidrólise?
Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de
xenônio citado, quantos elétrons na camada de valência
haverá no átomo do gás nobre?
Na mitologia grega, Nióbia era a filha de Tântalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos. Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
KEAN, S. A colher que desaparece: e outras histórias reais de loucura, amor e morte a partir dos elementos químicos. Rio de Janeiro: Zahar, 2011 (adaptado).
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a
No Brasil, os postos de combustíveis comercializavam uma gasolina com cerca de 22% de álcool anidro. Na queima de 1 litro desse combustível são liberados cerca de 2 kg de CO2 na atmosfera. O plantio de árvores pode atenuar os efeitos dessa emissão de CO2. A quantidade de carbono fixada por uma árvore corresponde a aproximadamente 50% de sua biomassa seca, e para cada 12 g de carbono fixados, 44 g de CO2 são retirados da atmosfera. No Brasil, o plantio de eucalipto (Eucalyptus grandis) é bem difundido, sendo que após 11 anos essa árvore pode ter a massa de 106 kg, dos quais 29 kg são água.
Uma única árvore de Eucalyptus grandis, com as características descritas, é capaz de fixar a quantidade de CO2 liberada na queima de um volume dessa gasolina mais próximo de
Pesquisadores avaliaram a qualidade da água potável distribuída em cidades brasileiras. Entre as várias substâncias encontradas, destacam-se as apresentadas no esquema. A presença dessas substâncias pode ser verificada por análises químicas, como uma reação ácido-base, mediante a adição de hidróxido de sódio.
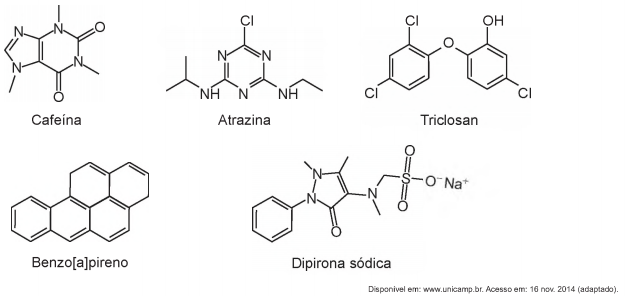
Apesar de não ser perceptível visualmente, por causa das condições de diluição, essa análise apresentará resultado
positivo para o(a)
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
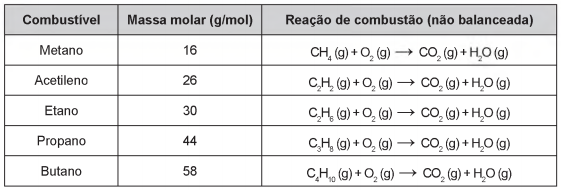
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite
mais CO2 é o
A bauxita, composta por cerca de 50% de Al2O3, é o mais importante minério de alumínio. As seguintes etapas são necessárias para a obtenção de alumínio metálico:
1. A dissolução do AI2O3 (s) é realizada em solução de NaOH (aq) a 175 “C, levando à formação da espécie solúvel NaAI(OH)4 (aq).
2. Com o resfriamento da parte solúvel, ocorre a precipitação do AI(OH)3 (s).
3. Quando o AI(OH)3 (s) é aquecido a 1 050 “C, ele se decompõe em Al2O3 (s) e H2O.
4. Al2O3 (s) é transferido para uma cuba eletrolítica e fundido em alta temperatura com auxílio de um fundente.
5. Através da passagem de corrente elétrica entre os eletrodos da cuba eletrolítica, obtém-se o alumínio reduzido no cátodo.
As etapas 1, 3 e 5 referem-se, respectivamente,
a fenômenos:
No ar que respiramos existem os chamados “gases inertes”. Trazem curiosos nomes gregos, que significam “o Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes, tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prêmio Nobel.
LEVI, P. A tabela periódica. Rio de Janeiro: Relume-Dumará, 1994 (adaptado).
Qual propriedade do flúor justifica sua escolha como reagente para o processo mencionado?
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
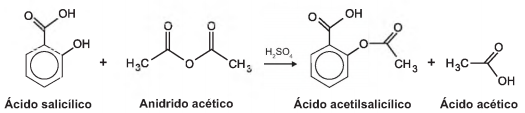
Após a síntese, o AAS é purificado e o rendimento flnal é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do
texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?