O peróxido de hidrogênio é comumente utilizado como ...
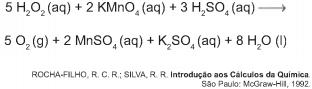
De acordo com a estequiometria da reação descrita, a quantidade de permanganato de potássio necessária para reagir completamente com 20,0 mL de uma solução 0,1 mol/L de peróxido de hidrogênio é igual a
Comentários
Veja os comentários dos nossos alunos
1L = 1000mL, portanto 20mL de peróxido de hidrogênio são 0,02L.
Se concentração da solução é 0,1 mol/L, então 0,02L equivalem a 0,002 mol (=2.10^-3).
De acordo com a reação, 5 mol de peróxido reagem com 2 mol de permanganato.
Seguindo a proporção 0,002 mol vai reagir então com 0,0008 ou 8.10^-4 (letra D)
1)Identificar as substâncias utilizadas, que já estão balanceadas:
5H2O2 ---- 2KMnO4
5 mols ------------- 2 mols
5 . 22,4L --------- 2 . 22,4L
0,02L ------------ X
X = 0,02 . 2 . 22,4 / 22,4 . 5 = 0,008 = 8 . 10^-3
Essa solução é para 1 mol por L, e ele pede para 0,1 mol/L:
8 . 10^-3 ------- 1L
X -------- 0,1L
X = 8 . 10^-4
mas ele não falou que estão na CNTP
Não tem necessidade de multiplicar por 22,4 L. Vai cortar de qualquer jeito po.
1)Em
1L------ 0,1 mol
20ml-----x mol
x= 2.10^-3 mol
2) 5mol ----- 2 mol
2.10^-3 mol ----- Y mol
y= 8.10^-4
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo