Questões Militares
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 31 questões

Com base nesses dados, é correto afirmar que o gás que descreve o reagente limitante é o
Com base nesses dados, é correto afirmar que o tempo, em horas, necessário para que seja alcançada a conversão XA = 0,9 é de
A esse respeito, é correto afirmar que a desativação de um catalisador ocorre
( ) A influência da difusão em uma reação catalítica sólido-fluido pode ser medida pelo quociente (-ra)medida ÷ (-ra)calculada, em que (-ra)medida é a velocidade da reação obtida experimentalmente e (-ra)calculada é a velocidade da reação calculada sem considerar a influência da difusão. ( ) Quando o catalisador sofre desativação em um reator de mistura, com o passar do tempo a concentração de reagente tende a aumentar até atingir a concentração inicial. ( ) Quando a difusão do fluido reagente nos poros do catalisador sólido é muito rápida, ela não precisa ser considerada nos cálculos cinéticos. ( ) Em um reator de leito fixo em estágios, a quantidade de catalisador em cada estágio é superior à do estágio anterior, para que o fluxo volumétrico de fluido reagente seja aumentado em cada estágio. ( ) A desativação do catalisador resulta em um aumento na concentração de reagente quando a reação ocorre em um reator batelada.
De acordo com as afirmações, a sequência correta é
Considere a reação de queima do etanol
C2H5OH(l) + 3O2(g) →2CO2(g) + 3H2O(l) ΔcH (298 K; 1 bar) = -1368,0 kJ.mol-1
Se a combustão ocorre em recipiente exposto, à pressão atmosférica e as espécies gasosas se comportam
idealmente, a variação de energia interna por mol de etanol oxidado é
A reação elementar de segunda ordem, em fase líquida
2A → B
é conduzida isotermicamente, à 40° C, em um reator batelada de 100 dm3 . A constante de velocidade, na temperatura de operação do reator, é igual a 0,2 dm3 .mol-1.min-1. Cinquenta mols do reagente A são adicionados puros ao reator no início do processo.
O tempo necessário, em minutos, para que 50% de A seja consumido é igual a
O ácido acético pode ser produzido por meio da hidrólise do anidrido acético em fase líquida, conforme a seguinte reação.
(CH3CO)2O + H2O ⟶ 2 CH3COOH
A combustão do butano é dada pela seguinte reação.
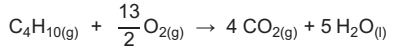
É correto afirmar que, para uma velocidade de consumo de C4
H10 igual a 2,0 mol.dm−3.s−1, as velocidades de
consumo de O2
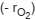 e de formação de CO2
e de formação de CO2 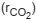 e H2O (rH2O), são iguais, respectivamente, a
e H2O (rH2O), são iguais, respectivamente, a
O ácido sulfúrico pode ser produzido a partir de diversas fontes de enxofre. Uma dessas fontes é o mineral pirita (FeS2 ) que passa por um processo conhecido como ustulação. A ustulação consiste em aquecer o mineral sulfetado a altas temperaturas, na presença de oxigênio, o que leva à produção de dióxido de enxofre (SO2 ). O dióxido de enxofre é então oxidado a trióxido de enxofre (SO3 ), na presença de catalisador, o qual é absorvido em água para a produção de ácido sulfúrico.
O óxido metálico obtido segue para as rotas seguintes de tratamento. Para a pirita, a etapa de ustulação até a de produção de ácido sulfúrico pode ser representada pelas seguintes equações químicas.
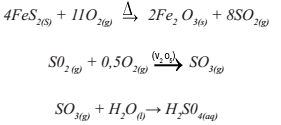
Dados: FeS2 = 120g/mol; Fe2 O3 = 160g/mol; O2 = 32g/mol; SO2 = 64g/mol; SO3 =80g/mol; H2O = 18g/mol; H2SO4 = 98g/mol
Dado que o mineral pirita é composto por 47% de ferro e 53% de enxofre, em massa, uma empresa que
produz 20.000 toneladas por mês de ácido sulfúrico, utilizando um material composto por 70% de pirita e 30%
de impurezas. Por mês, a quantidade, em toneladas, de pirita impura consumida pela empresa
Em um reator foram colocados 50mol de uma substância A e 50mol de uma substância B. Essas substâncias reagem segundo as equações.
A + B ⇄ C
A + C ⇄ D
Quando o sistema atinge o equilíbrio, as frações molares de A e B são 0,05 e 0,10, respectivamente. Já as
frações de C e D são:
Catalisadores são substâncias que diminuem a energia de ativação de uma dada reação, sem alterar quais são os produtos formados ou a estequimetria da reação. Imagine que você esteja produzindo N2 e H2 a partir da decomposição da amônia.
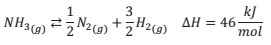
A energia de ativação para essa reação é igual a 150kJ/mol, em um meio homogêneo, na ausência de um catalisador, e cai para 87kJ/mol na presença de um catalisador sólido específico.
Considere as seguintes afirmações sobre a decomposição da amônia.
I. A velocidade da reação na superfície do catalisador depende da área superficial do catalisador.
II. As constantes de velocidade para os dois casos (sem e com catalisador) são iguais.
III. A velocidade no meio homogêneo é igual a da mesma reação no meio heterogêneo.
Está correto o que se afirma em:
O dono de uma empresa verificou que aumentaria muito seus lucros caso passasse a produzir uma de suas matérias-primas, ao invés de comprá-la, apesar do investimento inicial necessário. Essa matéria-prima é produzida a partir da decomposição de uma dada substância A. Ele desejava conseguir uma conversão de 85% utilizando até três reatores, com o menor volume total possível. Primeiramente, ele pediu a um de seus funcionários que estudasse como a velocidade da reação se correlacionava com a conversão do reagente A.
O funcionário apresentou a tabela a seguir, em que a variação do número de moles do reagente A (dNA/dt) está expressa em mol/s.

A partir desses dados, foi possível desenhar o gráfico a seguir
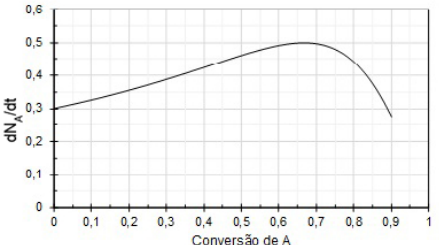
Fonte: Arquivo da Banca Elaboradora.
Assim, o dono da empresa verificou que, para atender suas condições, o ideal seria utilizar um
O gráfico a seguir representa a variação de concentração das espécies A, B e C com o tempo:
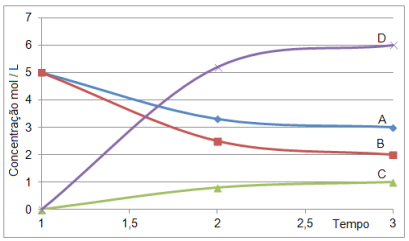
Mediante a reação representada pelo gráfico, marque a alternativa que representa corretamente a equação
química.
Um catalisador é uma substância que faz variar a velocidade de uma reação química sem que ele próprio sofra uma variação química permanente no processo. Os catalisadores são bem comuns, muitas reações na indústria química ocorrem com a ajuda de catalisadores.
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre a Catálise Homogênea.
( ) Os catalisadores podem agir aumentando a velocidade de reação, mas não alteram o número de colisões efetivas.
( ) Os átomos de cloro são catalisadores para a destruição do ozônio.
( ) Na ausência do catalisador, as reações ocorrem de maneira extremamente lenta.
A alternativa que apresenta a sequência correta é
Os confinamentos nos quais ocorrem reações químicas são chamados reatores. Existem vários tipos de reatores químicos e várias maneiras de classificá-los.
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre Reatores.
( ) O reator em batelada é um tipo de vaso largamente usado em processos industriais. As vantagens de um reator de batelada residem em sua versatilidade.
( ) Reator perfeitamente agitado (RPA) é um tipo de reator ideal comum em engenharia química. Frequentemente refere-se a um modelo usado para estimar as variáveis principais de uma operação unitária.
( ) Reator de fluxo em pistão (PFR) é usado para descrever reações químicas em sistemas de fluxo contínuo.
( ) A manutenção de reatores RPA é mais cara do que a manutenção dos reatores RFP.
( ) Reatores de fluxo em pistão têm uma conversão por unidade de volume baixa, mas operam por longos períodos de tempo sem manutenção.
A alternativa que apresenta a sequência correta é
Reatores em batelada operando adiabaticamente são frequentemente empregados para a determinação de ordens de reação, de energias de ativação e de velocidades específicas de reações exotérmicas. Essas determinações são feitas através do monitoramento das trajetórias temperatura-tempo para diferentes condições iniciais. A respeito da operação adiabática de um reator em batelada, analise as afirmativas.
I. Equação de projeto: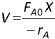
II. Balanço de energia quando o trabalho executado pelo misturador puder ser desprezado: 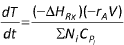
III. Para determinar o tempo necessário para obtenção de uma conversão específica: 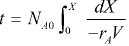
Está(ão) correta(s) apenas a(s) afirmativa(s)