Questões Militares
Sobre controle físico-químico em farmácia
Foram encontradas 137 questões
“Para se efetuar a medição de uma massa, as balanças devem apresentar capacidade e sensibilidade de acordo com o grau de precisão requerido e certificado de calibração atualizado. Tratando-se de atividades que exijam pesagens exatas, na determinação de massas iguais ou maiores que 50 mg, deve-se utilizar balança analítica de _____ de capacidade e ______ de sensibilidade. Para quantidades inferiores a 50 mg, deve-se utilizar balança analítica de ______ de capacidade e ______ de sensibilidade.”
Nos ensaios de dissolução, a condição sink é definida como sendo, no mínimo, _____ vezes o volume de meio necessário para se obter uma solução saturada do IFA, considerando a maior dose comercializada do produto.
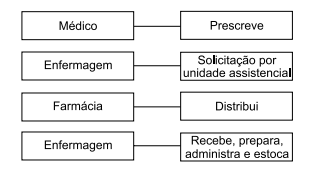
Assinale a alternativa que completa corretamente a lacuna do fluxograma a seguir.
Fluxograma do sistema de distribuição ___________
“As balanças devem estar niveladas na ocasião de seu uso. A posição de equilíbrio com ou sem carga deve ser conferida várias vezes com_________ da carga total e com a carga total. A diferença de equilíbrio, encontrada em duas determinações sucessivas, feitas com pesos iguais, não deve exceder_________ para balanças analíticas (máximo de__________ ) e ____________para balanças analíticas (máximo de_____________ ).”
“Resíduo por incineração ( ________ ) é o resíduo não volátil de uma amostra incinerada na presença de ________. Este ensaio é utilizado para determinar conteúdo de impurezas ________ presentes em uma substância ________.”
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
No processo de extração de analitos por partição, se a matriz for aquosa, os analitos apolares tendem a se dissolver na fase extratora apolar, ________ na matriz. A amostra e a fase extratora são colocadas em contato até que seja alcançado o equilíbrio na distribuição dos analitos entre as duas fases. A constante de distribuição (K) pode ser determinada a partir da razão entre a ________.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
De acordo com o Guia de Qualidade Quality Risk Management do International Conference on Harmonization (ICH-Q9) e com os requisitos de boas práticas de fabricação, o gerenciamento de risco da qualidade é um processo sistemático de avaliação, controle, comunicação e revisão de riscos para a qualidade do medicamento. Para uso na indústria farmacêutica, dois princípios básicos devem ser considerados: ser baseado em conhecimentos científicos e utilizar de documentação e nível de esforço proporcionais ao nível de risco. Nesse sentido, diversas ferramentas de análise de risco de complexidades distintas são comumente utilizadas, devendo ser aplicadas em conformidade com o nível do risco avaliado.
São exemplos de ferramentas de análise de risco, exceto
O gráfico mostra uma carta controle hipotética do teste de determinação de peso, obtida durante a análise de Controle Estatístico de Processo, referente ao período de um ano de coleta de dados na revisão de qualidade de um produto (Revisão Periódica de Produto) na forma farmacêutica comprimido.
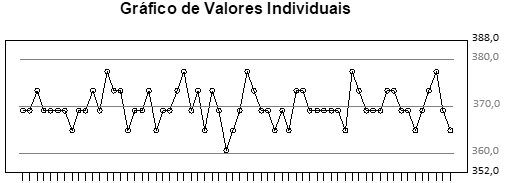
Fonte: Arquivo da Banca Elaboradora.
Pela análise do gráfico, é correto afirmar que
O processo de compressão de comprimidos acontece mediante a aplicação de uma força externa sobre as partículas de um pó ou de outro sistema particulado sólido, resultando na transferência de força através dos pontos de contato interparticulares, promovendo assim uma deformação no material. Esta deformação pode apresentar comportamento do tipo elástico, plástico ou destrutivo.
Sobre o processo de compressão, é correto afirmar que
A maioria dos compostos orgânicos podem se cristalizar em duas ou mais estruturas sólidas tridimensionais, capacidade que recebe o nome de polimorfismo. Na indústria farmacêutica, o polimorfismo é considerado um fenômeno de grande importância, pois pode alterar propriedades como biodisponibilidade, processabilidade e estabilidade do insumo farmacêutico ativo.
São propriedades que podem diferir entre distintas formas polimórficas de um mesmo insumo farmacêutico ativo, exceto as da sequência indicada em
O teste de dissolução possibilita determinar a quantidade de substância ativa dissolvida no meio de dissolução quando o produto é submetido à ação de aparelhagem específica, sob condições experimentais descritas. Na avaliação dos resultados dos testes de dissolução, a quantidade de substância ativa (fármaco) dissolvida é determinada pelo termo “Q”, sendo o valor de Q especificado na monografia individual do produto. Quando se trata de produtos de liberação prolongada, aplicam-se os termos Q1 e Q2, que correspondem à quantidade mínima e máxima de fármaco dissolvido em cada intervalo de tempo especificado na monografia, expressos como porcentagem da quantidade declarada.
A respeito do método de avaliação da dissolução (liberação), dos estágios de avaliação da liberação (L) e dos critérios de aceitação do teste de dissolução (liberação) para formas farmacêuticas de liberação prolongada, como o Adalat Oros®, é correto afirmar que
As formas farmacêuticas sólidas orais de liberação modificada são concebidas para modularem a liberação do fármaco, retardando ou prolongando a sua dissolução. Um exemplo de medicamento que possui liberação modificada é o Adalat Oros®, comprimidos de liberação prolongada indicados para tratamento da hipertensão arterial e doença arterial coronária. São comprimidos que possuem um sistema baseado na pressão osmótica (bomba osmótica), no qual o fármaco está contido em uma matriz revestida por uma membrana semipermeável, contendo um orifício. A membrana permite a penetração da água no comprimido, permitindo o “bombeamento” do fármaco através do orifício, o que possibilita sua liberação constante, sem interferência do pH do meio. A taxa na qual a água é capaz de passar por meio da membrana e o quão rapidamente a solução (ou suspensão) de fármaco é capaz de passar para fora pelo orifício controlam a taxa de liberação de fármaco. Esse sistema de liberação requer excipientes farmacêuticos específicos.
São exemplos de excipientes que podem ser usados para a constituição de bombas osmóticas, utilizadas em formas farmacêuticas orais de liberação prolongada, exceto
Quando uma substância ativa farmacêutica é instável em solução, a técnica de secagem por liofilização é frequentemente utilizada para fornecer a estabilidade requerida. Resumidamente, o processo de liofilização divide-se em 3 etapas: (1) congelamento; (2) secagem primária e (3) secagem secundária.
Informe se é verdadeiro (V) ou falso (F) o que se afirma sobre a técnica de secagem por liofilização.
( ) Em muitos casos, é necessário adicionar à formulação que será submetida à liofilização excipientes que atuarão como agentes de volume (bulk). Açúcares, como o manitol, são geralmente utilizados nesta função.
( ) Na primeira etapa de liofilização (congelamento), o soluto pode se comportar como um sólido cristalino, que congela em temperaturas abaixo do seu ponto de transição vítrea (Tg), ou como um sólido amorfo, que congela em temperaturas abaixo de sua temperatura eutética (Teu).
( ) O fenômeno físico que ocorre na segunda etapa de liofilização (secagem primária) denomina-se evaporação.
( ) A liofilização é um evento dependente exclusivamente da temperatura, sendo a capacidade de controle da pressão irrelevante em equipamentos liofilizadores.
A sequência correta é
Segundo o Guia de dissolução aplicável a medicamentos genéricos, novos e similares (Guia nº 14 – versão 1 – ANVISA -2018), A Dissolução é o processo de liberação do insumo farmacêutico ativo (IFA) de sua forma farmacêutica, tornando-o disponível para absorção. O ensaio de dissolução é um teste físico-químico importante para demonstrar in vitro o desempenho de produtos que necessitam de dissolução para absorção e, consequente, efeito terapêutico.
O volume do meio de dissolução empregado depende, em grande parte, da solubilidade do IFA e da capacidade em manter a condição sink, cujo alcance é importante para evitar que a velocidade de dissolução seja influenciada, de maneira artificial, pela aproximação da saturação durante a realização do teste.
A condição sink é definida como sendo no mínimo três vezes o volume de meio necessário para se obter uma solução saturada do IFA, considerando a maior dose comercializada do produto. Nesta etapa, utiliza-se a maior dose comercializada, pois o ensaio de dissolução será realizado com apenas uma unidade farmacotécnica.
Avalie a seguinte situação:
Um farmacêutico deseja determinar a condição sink de um determinado IFA em diferentes meios de dissolução. A solubilidade desse IFA foi verificada em diferentes pH, e os resultados estão apresentados na Tabela 1.
Ele utilizará 500 ml de meio para realizar os testes de dissolução, considerando um comprimido contendo 8 mg de IFA.
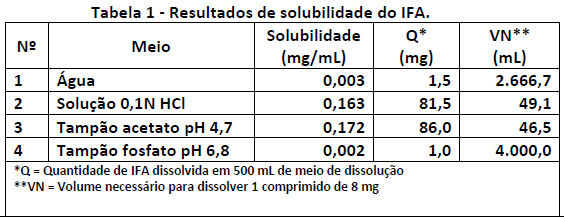
De acordo com os resultados acima, conclui-se que a condição sink será alcançada: