Questões Militares
Sobre validação de métodos analíticos e garantia da qualidade em farmácia
Foram encontradas 141 questões
Assinale o item que apresenta a sentença correta.
Assinale os programas de sistema de qualidade que podem ser utilizados para implementação da gestão de qualidade em uma indústria farmacêutica.
Analise as afirmativas abaixo e marque a sequência correta de respostas verdadeiras (V) ou falsas (F).
( ) A precisão é a avaliação da proximidade dos resultados obtidos em uma série de medidas de uma amostragem múltipla de uma mesma amostra.
( ) Especificidade e seletividade são a capacidade de uma metodologia analítica de demonstrar que os resultados obtidos são diretamente proporcionais à concentração do analito na amostra, dentro de um intervalo especificado. ( ) Linearidade é a capacidade que o método possui de medir exatamente um composto em presença de outros componentes tais como impurezas, produtos de degradação e componentes da matriz.
( ) Limite de quantificação é a menor quantidade do analito presente em uma amostra que pode ser detectado, porém não necessariamente quantificado, sob as condições experimentais estabelecidas.
( ) Limite de detecção é a menor quantidade do analito em uma amostra que pode ser determinada com precisão e exatidão aceitáveis sob as condições experimentais estabelecidas.
Leia o texto da RDC 210 e complete as lacunas com a sequência de palavras corretas.
“O programa de autoinspeção deve ser projetado de forma a detectar qualquer __________ na implementação das BPF e de recomendar as ações corretivas necessárias. A __________ deve ser realizada rotineiramente nos casos de___________ de produtos ou de reprovações repetidas. Todas as recomendações sobre medidas corretivas devem ser implementadas. Os procedimentos para a realização da autoinspeção devem ser ________________ e também possuir um programa efetivo de acompanhamento."
Segundo a RDC 210/03 ANVISA, a ocorrência de contaminação cruzada deve ser evitada através de técnicas apropriadas ou de medidas organizacionais, tais como
I. produção em instalações exclusivas e separadas para os vários fármacos que serão fabricados, acompanhados de processos de limpeza e descontaminação devidamente validados.
II. utilização de antecâmaras, com diferenciais de pressão de ar.
III. redução ao máximo do risco de contaminação causada pela recirculação ou reentrada de ar não tratado ou insuficientemente tratado.
IV. utilização de roupas protetoras nas áreas somente onde estejam sendo processados produtos que apresentem risco de contaminação cruzada.
V. utilização de um “sistema aberto de produção".
Analise os itens acima e marque a resposta que apresenta as afirmativas corretas.
Analise o quadro abaixo e assinale a resposta correta para completar a sequência dos fatores que devem ser considerados na robustez dos métodos analíticos descritos.
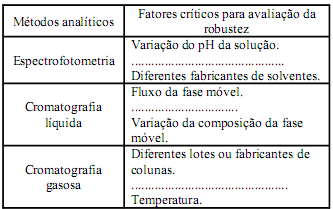
Validação significa provar e documentar resultados que indiquem que o método utilizado é seguro dentro dos limites estabelecidos. A grande maioria dos processos relacionados à produção requer documentação detalhada de todas as etapas, com mecanismos de controle, qualificação de equipamentos, entre outros.
Logo abaixo, há um quadro que apresenta alguns processos e respectivos requisitos para sua validação.
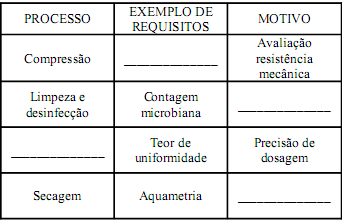
Marque a opção em que as palavras abaixo completam, na ordem em que se apresentam, a tabela acima.
No final dos anos 60, a imprensa europeia publicou que um paciente perdeu a visão e outros mais sofreram graves lesões nos olhos que comprometeram seriamente a sua visão. A investigação apontou o fabricante da pomada oftálmica como responsável, porque este produto, por conter antibióticos de amplo espectro e um esteroide, não continha conservantes.O fabricante considerou que a presença de antibióticos e o baixo conteúdo de água eram suficientes para prevenir o crescimento bacteriano. Foram analisadas 60 bisnagas do produto, sendo que 47 apresentaram elevada contaminação por pseudomonas aeruginosa, conforme mostra o quadro abaixo:
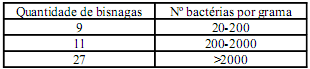
O fato citado evidenciou problemas de fabricação e controle que a indústria deveria corrigir.
Com base nas Boas Práticas de Fabricação, constante na RDC ANVISA n. 210, analise as afirmativas abaixo, relativas a prováveis soluções dentro dos padrões do controle de qualidade.
1. Realizar um número suficiente de testes de controle para verificar se as operações de processamento, fabricação e embalagem permitem alcançar os requisitos de qualidade.
2. Fornecer instruções e tomar as providências necessárias para garantir que os medicamentos sejam armazenados pelo fabricante, distribuídos e subsequentemente manuseados, de forma que a qualidade dos mesmos seja mantida por todo o prazo de validade.
3. Realizar procedimentos de organização, documentação e procedimentos de liberação que asseguram que os ensaios necessários e relevantes sejam executados e que os materiais não sejam liberados para uso, nem os produtos liberados para venda ou fornecimento, até que a qualidade dos mesmos seja julgada satisfatória.
4. Realizar atividades de sanitização e higiene que devem abranger pessoal, instalações, equipamentos e aparelhos, materiais de produção e recipientes, produtos para limpeza e desinfecção e qualquer outro aspecto que possa constituir fonte de contaminação para o produto.
Assinale a opção que melhor se adapta à solução do problema citado, de acordo com a RDC 210.