Questões Militares
Sobre gás ideal em física
Foram encontradas 46 questões
R=8,3 J/mol.K; Patm= 100.000 Pa.
Considerando que a temperatura do gás no ponto A vale TA = 50 K, assinale a alternativa que apresenta corretamente a temperatura TB do gás no ponto B.
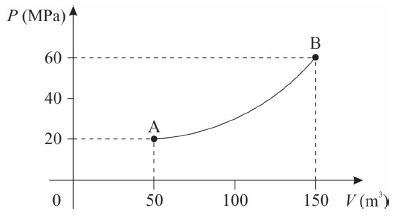
Quando precisar use os seguintes valores para as constantes:
Aceleração local da gravidade g = 10 m/s2 .
Constante gravitacional universal G = 6,67×10−11 m3 .kg−1.s−2 .
Velocidade da luz no vácuo c = 3,0×108 m/s.
Constante de Planck reduzida h = 1,05×10−34 J.s.
Permeabilidade magnética do vácuo µ0 = 4π×10−7 N.A−2 .
Carga elétrica elementar e = 1,6×10−19C.
Massa do elétron m0 = 9,1×10−31 kg.
Constante eletrostática do vácuo K0 = 9,0×109 N.m2.C-2.
Nas questões de Física, quando necessário, use:
• massa atômica do hidrogênio: mH = 1,67⋅10 –27 kg
• massa atômica do hélio: mHe = 6,65⋅10 –27 kg
• velocidade da luz no vácuo: c = 3⋅10 8 m/s
• constante de Planck: h = 6⋅10 –34 J⋅s
• 1 eV = 1,6⋅10 –19 J
• constante eletrostática do vácuo: k0 = 9,0⋅10 9 N⋅m 2 / C2
• aceleração da gravidade: g = 10 m/s2
• cos 30º = sen 60º = √3/2
• cos 60º = sen 30º = √1/2
• cos 45º = sen 45º = √2/2
Considere uma dada massa gasosa de um gás perfeito que pode ser submetida a três transformações cíclicas diferentes I, II e III, como mostram os respectivos diagramas abaixo.
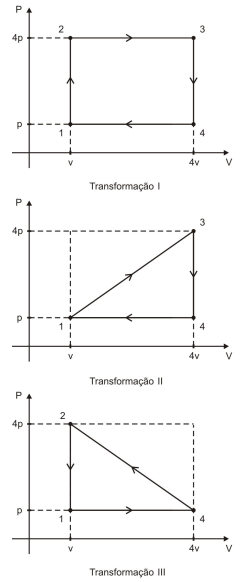
O gás realiza trabalhos totais τI, τII e τIII respectivamente nas transformações I, II e III.
Nessas condições, é correto afirmar que
Analise o gráfico abaixo.
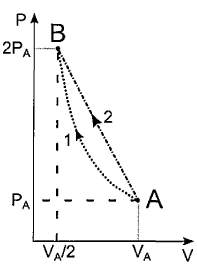
Um mol de certo gás ideal monoatômico, no estado inicial
(PA, VA, TA), deve ter sua pressão dobrada e seu volume
reduzido à metade, atingindo o estado (PB, VB, TB). Para
isso, dois processos distintos são testados
separadamente: o processo 1 é isotérmico, com o gás
cedendo ao meio externo um calor Q1. Já no processo 2, a
curva AB é retilínea, e o calor cedido pelo gás é
Q2 = Q1/0,92. Sendo R a constante dos gases ideais, o
produto RTA=U0 e W1 o trabalho realizado sobre o gás no
processo 1, a razão W1/U0 vale:
Um gás ideal é comprimido por um agente externo, ao mesmo tempo em que recebe calor de 300 J de uma fonte térmica.
Sabendo-se que o trabalho do agente externo é de 600 J, então a variação de energia interna do gás é
O diagrama Volume versus Temperatura, a seguir, representa uma transformação gasosa, I → II → III, sofrida por um mol de gás ideal.
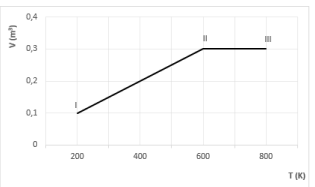
Considerando R = 2,0 cal/mol.K, qual é o trabalho realizado pelo gás nesse processo?
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
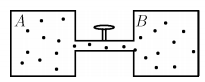
Dois recipientes A e B de respectivos volumes VA e VB = βVA , constantes, contem um gás ideal e são conectados por um tubo fino com válvula que regula a passagem do gás, conforme a figura. Inicialmente o gás em A está na temperatura TA sob pressão PA e em B, na temperatura TB sob pressão Pb . A válvula e então aberta até que as pressões finais PAf e PBf alcancem a proporção PAf / PBf = α, mantendo as temperaturas nos seus valores iniciais. Assinale a opcão com a expressão de PAf .
A teoria cinética dos gases se baseia em quatro postulados; analise-os.
I. O gás é formado por moléculas que se encontram em movimento desordenado e permanente. Cada molécula pode ter velocidade diferente das demais.
II. Cada molécula do gás interage com as outras somente por meio de colisões (forças normais de contato). A única energia das moléculas é a energia cinética.
III. Todas as colisões entre as moléculas e as paredes do recipiente que contêm o gás são perfeitamente elásticas. A energia cinética total se conserva, mas a velocidade de cada molécula pode mudar.
IV. As moléculas são infinitamente pequenas. A maior parte do volume ocupado por um gás é o espaço vazio.
Estão corretas as afirmativas
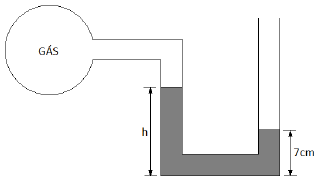
A altura h no lado esquerdo do manômetro, considerando que o mesmo se encontra ao nível do mar, é de: (Considere: 1 atm = 760 mmHg.)