Questões Militares
Comentadas sobre gás ideal em física
Foram encontradas 21 questões
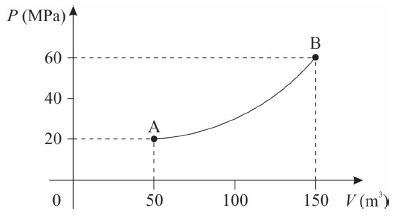
Considerando que a temperatura do gás no ponto A vale TA = 50 K, assinale a alternativa que apresenta corretamente a temperatura TB do gás no ponto B.
Nas questões de Física, quando necessário, use:
• massa atômica do hidrogênio: mH = 1,67⋅10 –27 kg
• massa atômica do hélio: mHe = 6,65⋅10 –27 kg
• velocidade da luz no vácuo: c = 3⋅10 8 m/s
• constante de Planck: h = 6⋅10 –34 J⋅s
• 1 eV = 1,6⋅10 –19 J
• constante eletrostática do vácuo: k0 = 9,0⋅10 9 N⋅m 2 / C2
• aceleração da gravidade: g = 10 m/s2
• cos 30º = sen 60º = √3/2
• cos 60º = sen 30º = √1/2
• cos 45º = sen 45º = √2/2
Considere uma dada massa gasosa de um gás perfeito que pode ser submetida a três transformações cíclicas diferentes I, II e III, como mostram os respectivos diagramas abaixo.
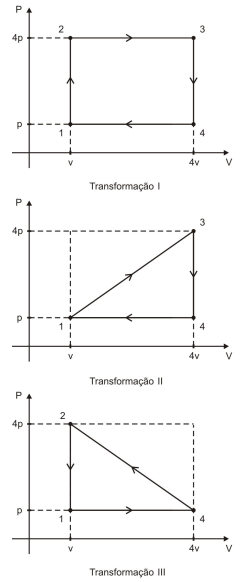
O gás realiza trabalhos totais τI, τII e τIII respectivamente nas transformações I, II e III.
Nessas condições, é correto afirmar que
Analise o gráfico abaixo.
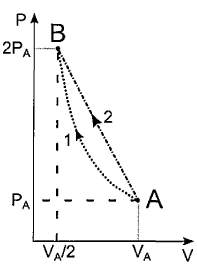
Um mol de certo gás ideal monoatômico, no estado inicial
(PA, VA, TA), deve ter sua pressão dobrada e seu volume
reduzido à metade, atingindo o estado (PB, VB, TB). Para
isso, dois processos distintos são testados
separadamente: o processo 1 é isotérmico, com o gás
cedendo ao meio externo um calor Q1. Já no processo 2, a
curva AB é retilínea, e o calor cedido pelo gás é
Q2 = Q1/0,92. Sendo R a constante dos gases ideais, o
produto RTA=U0 e W1 o trabalho realizado sobre o gás no
processo 1, a razão W1/U0 vale:
Um gás ideal é comprimido por um agente externo, ao mesmo tempo em que recebe calor de 300 J de uma fonte térmica.
Sabendo-se que o trabalho do agente externo é de 600 J, então a variação de energia interna do gás é
O diagrama Volume versus Temperatura, a seguir, representa uma transformação gasosa, I → II → III, sofrida por um mol de gás ideal.
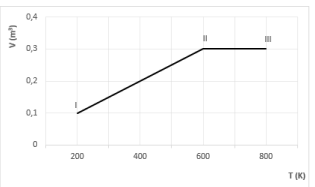
Considerando R = 2,0 cal/mol.K, qual é o trabalho realizado pelo gás nesse processo?
Em um cilindro isolado termicamente por um pistão de peso desprezível encontra-se m = 30 g de água a uma temperatura de 0°C. A área do pistão é S = 512 cm2 , a pressão externa é p = 1 atm. Determine a que altura, aproximadamente, eleva-se o pistão, se o aquecedor elétrico, que se encontra no cilindro, desprende Q = 24 200 J.
Dados: Despreze a variação do volume de água;
1 cal = 4,2 J; R = 0,082 atm.L/mol.K;
MH2O = 18 g/mol); cágua = 1,0 cal/gºC; e
Lvapor = 540 cal/g.
Ao estudar as transformações termodinâmicas, um aluno lê a seguinte anotação em um livro:
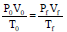
Onde P0 e Pf são as pressões inicial e final, V0 e Vf são os
volumes inicial e final; e T0 e Tf são as temperaturas inicial e
final de uma amostra de gás ideal. O aluno pode afirmar
corretamente que, nessa anotação, 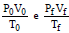 se referem
se referem
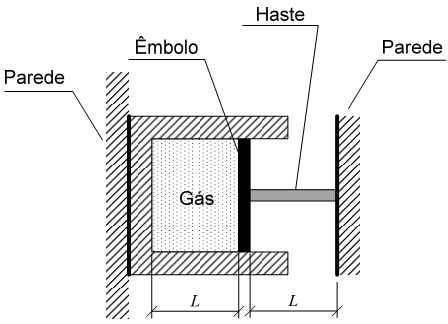
Um êmbolo está conectado a uma haste, a qual está fixada a uma parede. A haste é aquecida, recebendo uma energia de 400 J. A haste se dilata, movimentando o êmbolo que comprime um gás ideal, confinado no reservatório, representado na figura. O gás é comprimido isotermicamente.
Diante do exposto, o valor da expressão: Pf - Pi /Pf é
Dados:
• pressão final do gás: Pf ;
• pressão inicial do gás: Pi ;
• capacidade térmica da haste: 4 J/K;
• coeficiente de dilatação térmica linear da haste: 0,000001 K-1 .
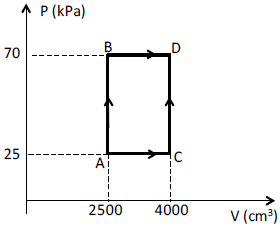
O diagrama PV da figura mostra, para determinado gás ideal, alguns dos processos termodinâmicos possíveis. Sabendo-se que nos processos AB e BD são fornecidos ao gás 120 e 500 joules de calor, respectivamente, a variação da energia interna do gás, em joules, no processo ACD será igual a
Um recipiente cilíndrico fechado contém 60,0 litros de oxigênio hospitalar (O2) a uma pressão de 100 atm e temperatura de 300 K. Considerando o O2 um gás ideal, o número de mols de O2 presentes no cilindro é
Dado: constante gás ideal 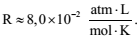
recipiente de 48,0 L, onde a temperatura é mantida constante e
igual a 300 K. A partir dessa informação, julgue os itens que se
seguem, considerando que a constante universal dos gases

recipiente de 48,0 L, onde a temperatura é mantida constante e
igual a 300 K. A partir dessa informação, julgue os itens que se
seguem, considerando que a constante universal dos gases

