Questões Militares
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 50 questões
Considerando a constante de Faraday 9,65 x 104 C.mol–1 , a massa máxima de níquel e ouro depositadas nesse período de funcionamento do sistema foi, respectivamente, de, aproximadamente,
2 Na+(eletrólito) + 2 e– ➝ 2 Na(l) Eº = –2,71 V S8 (l) + 16 e– ➝ 8 S2– (eletrólito) Eº = –0,51 V
O potencial padrão dessa bateria e o número de elétrons transferidos para cada molécula S8 (l), são, respectivamente,
Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:
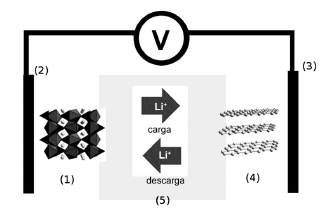
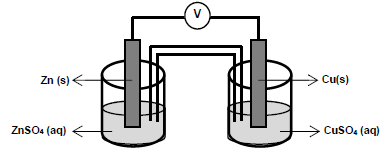
As semirreações que descrevem o processo de oxirredução estão descritas a seguir.
Cu2+ (aq) + 2e- → Cu(s) E0red = + 0,34 V (volts) Zn2+ (aq) + 2e- → Zn(s) E0red = - 0,76 V (volts)
Para o processo descrito, analise as afirmativas abaixo e dê valores Verdadeiro (V) ou Falso (F).
( ) O eletrodo de zinco sofre oxidação e o eletrodo de cobre sofre redução. ( ) A reação de oxidação ocorre no cátodo e reação de redução ocorre no ânodo. ( ) O diagrama de célula do processo é Zn (s)|Zn2+(aq)||Cu2+(aq)|Cu (s). ( ) Os elétrons fluem do ânodo para o cátodo. ( ) A reação global da pilha é Cu(s) + Zn2+(aq) → Cu2+(aq) + Zn(s) e a diferença de potencial é 1,10 V (volts).
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
O fósforo branco, substância química cuja estrutura é representada pela fórmula P4 , é utilizado em algumas munições fumígenas (munições que produzem fumaça). Ele pode ser obtido a partir da fosforita (Ca3(PO4)2), um mineral de fosfato de cálcio, por meio da reação com sílica (dióxido de silício - SiO2) e carvão coque (C) num forno especial a 1300 ºC.
A equação não balanceada da reação é:
Ca3(PO4)2 (s) + SiO2 (s) + C (s) → CaSiO3 (s) + CO (g) + P4 (s)
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular.
III – O agente redutor do processo é o dióxido de silício.
IV – Neste processo ocorre a oxidação do carbono.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Neste ano de 2019, foi realizada pelos alunos da EsPCEx uma prática no laboratório de química envolvendo eletrólise com eletrodos ativos conforme a descrição experimental:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de cobre II de concentração 1 mol.L-1. Tome como eletrodos uma barra fina de cobre e um prego de ferro. Ligue-os com auxílio de fios a uma fonte externa de eletricidade com uma corrente contínua de intensidade de 3 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. O prego deve ser ligado ao polo negativo da fonte e a barra de cobre ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 16 minutos e 5 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm) e o sal completamente dissociado, conforme visto na figura a seguir:
Dado: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
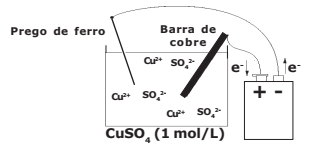
Na discussão apresentada nos relatórios dos diversos grupos de alunos, surgiram as seguintes afirmativas:
I – Na superfície do prego ocorreu a deposição de cobre metálico.
II – Durante o processo a barra de cobre se oxida.
III – A massa de cobre metálico que se depositou na superfície do prego foi de 2,45 g.
IV – A semi-reação de redução que ocorre no cátodo é Cu2+ + 2 e- → Cuº.
V – A reação global é Fe2+ + Cuº → Feº + Cu2+
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Quando um material sofre corrosão, é importante avaliar a composição desse material, o meio corrosivo e sob quais condições operacionais ele ficou exposto. De acordo com o tipo de material e o meio corrosivo, a corrosão pode ser química ou eletroquímica.
Associe corretamente o mecanismo de corrosão ao(s) respectivo(s) processo(s) de corrosão.
MECANISMOS DE CORROSÃO
(1) Químico
(2) Eletroquímico
PROCESSOS DE CORROSÃO
( ) Ataque da borracha por ozônio.
( ) Oxidação do ferro exposto ao ambiente.
( ) Ataque do aço inox pelo cloro, em presença de umidade.
( ) Oxidação do aço inox por O2, em ambiente seco, formando Cr2 O3
Sempre que se liga um aparelho de CD portátil ou um computador portátil, completa-se um circuito que permite que uma reação química ocorra em uma bateria – uma descendente direta da pilha de Volta de metais e papel. As pilhas e baterias são exemplos de células eletroquímicas.
Considere que uma pilha hipotética de dois metais X e Y tem a seguinte representação simbólica:
X (s) / X2+ (aq) // Y2+ (aq) / Y (s)
Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e –3,0 V.
Com base nessas informações, assinale a alternativa em que a característica dessa pilha está incorreta.
A remoção desse gás da atmosfera ocorre por:
Dados: massa molar do cobre = 64 g · mol-1 ; 1 Faraday = 96500 C · mol-1
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Por serem soluções eletrolíticas, as referidas bebidas conduzem
corrente elétrica.
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
Na reação de fenton, o peróxido de hidrogênio atua como agente
oxidante.
No ano de 2014, os alunos da EsPCEx realizaram um experimento de eletrólise durante uma aula prática no Laboratório de Química. Nesse experimento, foi montado um banho eletrolítico, cujo objetivo era o depósito de cobre metálico sobre um clipe de papel, usando no banho eletrolítico uma solução aquosa 1 mol·L-1 de sulfato de cobre II. Nesse sistema de eletrólise, por meio de uma fonte externa, foi aplicada uma corrente constante de 100 mA, durante 5 minutos. Após esse tempo, a massa aproximada de cobre depositada sobre a superfície do clipe foi de:
Dados: massa molar Cu = 64 g/mol; 1 Faraday = 96500 C
O cobre metálico pode ser oxidado por ácido nítrico diluído, produzindo água, monóxido de nitrogênio e um sal (composto iônico). A reação pode ser representada pela seguinte equação química (não balanceada):
Cu (s) + HNO3 (aq) → H2O (l) + NO (g) + Cu(NO3)2 (aq)
A soma dos coeficientes estequiométricos (menores números inteiros) da equação balanceada,
o agente redutor da reação e o nome do composto iônico formado são, respectivamente,
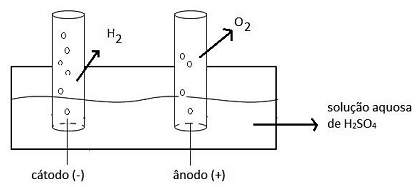
Com relação ao experimento, dentre as substâncias iniciais e as que foram formadas no processo de eletrólise da água, são consideradas substância simples, composta e mistura, respectivamente:
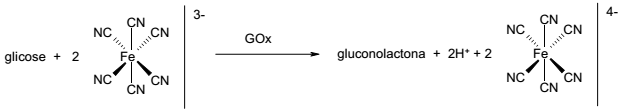
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
