Considere a pilha de Daniell formada por eletrodos de zinco...
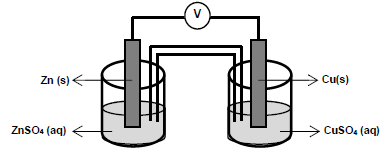
As semirreações que descrevem o processo de oxirredução estão descritas a seguir.
Cu2+ (aq) + 2e- → Cu(s) E0red = + 0,34 V (volts) Zn2+ (aq) + 2e- → Zn(s) E0red = - 0,76 V (volts)
Para o processo descrito, analise as afirmativas abaixo e dê valores Verdadeiro (V) ou Falso (F).
( ) O eletrodo de zinco sofre oxidação e o eletrodo de cobre sofre redução. ( ) A reação de oxidação ocorre no cátodo e reação de redução ocorre no ânodo. ( ) O diagrama de célula do processo é Zn (s)|Zn2+(aq)||Cu2+(aq)|Cu (s). ( ) Os elétrons fluem do ânodo para o cátodo. ( ) A reação global da pilha é Cu(s) + Zn2+(aq) → Cu2+(aq) + Zn(s) e a diferença de potencial é 1,10 V (volts).
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
- Gabarito Comentado (1)
- Aulas (10)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
2 - Em uma pilha de Daniell a reação de oxidação ocorre no ânodo e a reação de redução ocorre no cátodo, e não o contrário. Portanto, essa afirmativa é falsa.
5 - Para essa pilha, como o cobre sofre redução e o zinco sofre oxidação, tem-se as seguintes semirreações de redução e oxidação e reação global:
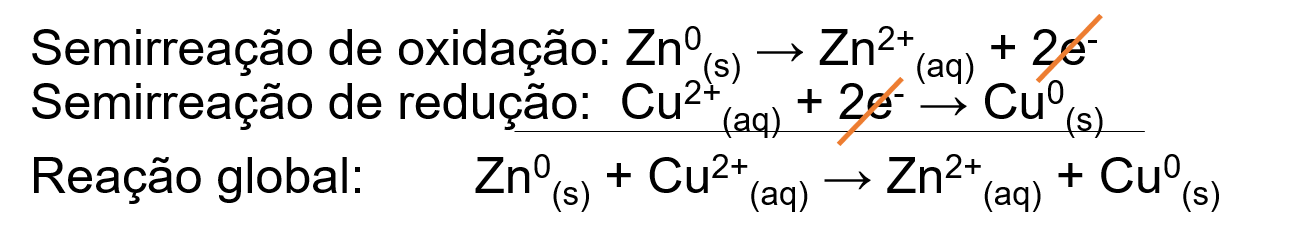
∆E0 = 0,34 - (-0,76) = 1,10 V
A afirmativa é falsa uma vez que a reação global está invertida.
Portanto, a ordem correta de cima para baixo é V, F, V, V, F.
Gabarito do Professor: Letra D.
2 - Em uma pilha de Daniell a reação de oxidação ocorre no ânodo e a reação de redução ocorre no cátodo, e não o contrário. Portanto, essa afirmativa é falsa.
3 - O zinco sofre oxidação, portanto ele vai de Zn(s) a Zn2+ e tem representação: Zn(s)|Zn2+(aq). O cobre sofre redução e vai de Cu2+(aq) a Cu0(s) e tem representação: Cu2+(aq)|Cu (s). Logo, a representação da pilha é Zn (s)|Zn2+(aq)||Cu2+(aq)|Cu (s), o que torna essa afirmativa verdadeira.
4 - A espécie que sofre oxidação doa elétrons para a substância que sofre redução. Portanto, os elétrons fluem do eletrodo onde acontece a oxidação (ânodo) para o eletrodo onde acontece a redução (cátodo) e essa afirmativa é verdadeira.
5 -
Redução: Cu2+ (aq) + 2e- → Cu(s)
Oxidação: Zn(s) → Zn2+ (aq) + 2e-
Global: Cu2+ (aq) + Zn(s) → Cu(s) + Zn2+ (aq)
A diferença de potencial é igual ao E0 de redução do que sofre redução menos o E0 padrão do que sofre oxidação:
ddp = E0 Cu - E0 Zn = 0,34 - (-0,76) = 1,10 V
A afirmativa é falsa uma vez que a reação global está invertida.
Gabarito do Professor: Letra D.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
V- Quem perde elétrons oxida, quem ganha elétrons reduz.
F- A redução ocorre no cátodo, e a oxidação no Ânodo.
V- Diagrama correto.
V- Ordem correta da célula Eletroquímica.
F- Equação Global Errada.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo