Questões Militares
Comentadas sobre equilíbrio químico em química
Foram encontradas 136 questões

Com base nessas informações, é correto afirmar que:
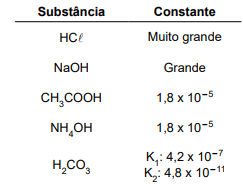
Considere a tabela dos valores de Kw a diferentes temperaturas.
T (ºC) Kw
10 0,29 × 10–14
15 0,45 × 10–14
20 0,68 × 10–14
25 1,01 × 10–14
30 1,47 × 10–14
50 5,48 × 10–14
Os valores de Kw mostram que, a 50 ºC, o pH da água
pura é

As melhores condições para que a formação do produto seja favorecida são:
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3 - (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3 - (aq) + OH- (aq) ⇄ H2O(l) + CO3 2- (aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
 1, na solução resultante é igual a
1, na solução resultante é igual a I. O aumento da pressão no reator, mediante adição de um gás inerte, aumenta o rendimento do processo. II. O uso de um catalisador mais efetivo aumenta o rendimento do processo. III. Uma vez atingido o equilíbrio, não ocorrem mais colisões efetivas entre moléculas de H2(g) e N2(g). IV. Considerando que ainda exista superação da energia de ativação, a redução da temperatura no reator diminui a velocidade da reação, mas favorece a formação de amônia.
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a reação de formação da amônia.
Anodo, H2 → 2H+ + 2e- (E° = 0 V) Catodo, Br2 + 2e- → 2Br- (E° = 1,087 V)
A dissociação da água pode ser observada pelo efeito da seguinte semirreação:
O2 + 4e-+ 4H+ → 2H2O E° = 1,229 V
A formação de complexos iônicos de polibrometo ocorre segundo as reações e suas respectivas constantes de equilíbrio:
Br2 + Br- ⇌ Br3- K3 = 16,7 2Br2 + Br- ⇌ Br5- K5 = 37,7
Sejam feitas as seguintes afirmações a respeito dessa bateria:
I. O potencial da célula pode ser aproximado pela equação: Ecatodo - Eanodo = 1,087 + 0,06 pH. II. O solvente (água) é termodinamicamente estável somente a pH < 2,4.
III. Recarregar a bateria com um potencial catódico inferior a 1,229 V garante a estabilidade do solvente. IV. Durante a descarga da bateria, a concentração do HBr aumenta e podem formar complexos ionicos de Br3- e Br5-.
Das afirmações acima, estão CORRETAS
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
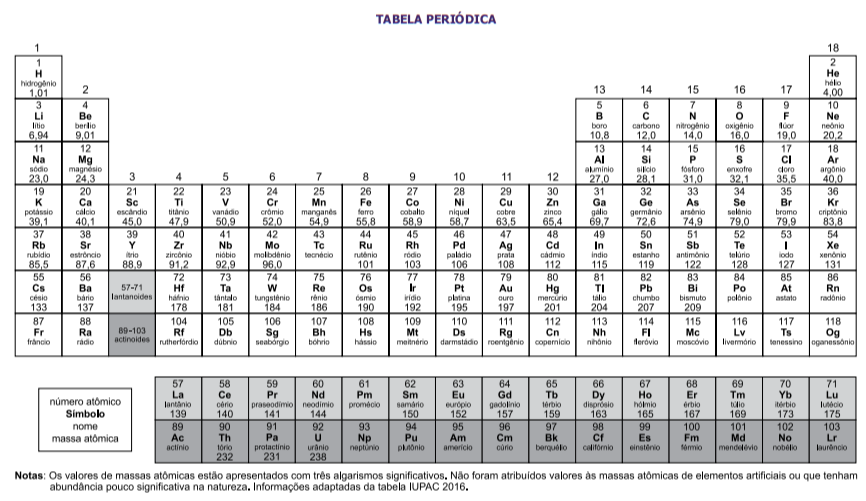
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o
O cianeto de sódio (NaCN) é um sal usado principalmente na indústria de mineração para a recuperação de metais preciosos. É produzido industrialmente pela reação entre ácido cianídrico e hidróxido de sódio, sendo recuperado, após a sua purificação, na forma cristalina ou na forma de soluções contendo entre 27 e 32% m/m.
Sabendo-se que, à temperatura de 25°C, a constante de dissociação do NaCN em água é igual a Ka = 6,2x10-10, é correto afirmar que, para uma concentração igual a 6,25 mol.L-1 (~ 27% m/m), a solução é
As soluções-tampão são muito utilizadas em processos químicos e biológicos para efetuar o controle de pH.
Com relação a essas soluções, avalie as afirmativas a seguir.
I. Um exemplo de solução-tampão é aquela que contém uma base fraca e um sal derivado desta base fraca.
II. A solução-tampão resiste às variações de pH quando se adicionam pequenas quantidades de um ácido ou de uma base.
III. Adicionando-se quantidades equimolares de ácido acético e de hidróxido de sódio à água, obtém-se uma solução-tampão.
É correto apenas o que se afirma em
A síntese do trióxido de enxofre é um processo exotérmico

A dependência da constante de equilíbrio (Keq) com a temperatura é dada pela equação de van’t Hoff
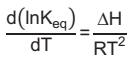
em que Keq é a constante de equilíbrio, ΔH é a entalpia da reação, R é a constante universal dos gases
(R = 8,3 J.mol-1.K-1) e T é a temperatura. Sabendo-se que Keq (300 K)=1 e considerando-se a entalpia da
reação aproximadamente constante nessa faixa de temperatura, o aumento da temperatura da reação de
20 °C desloca o equilíbrio da reação no sentido de formação dos
Um profissional do Corpo de Bombeiros Militar atua em diversas áreas de proteção e segurança da sociedade. Inicialmente, suas funções eram apenas de contenção e extinção de incêndios. Com o tempo, suas funções foram redefinidas, tornando-se um profissional responsável pela preservação do patrimônio ameaçado de destruição, salvamentos e conscientização civil das medidas básicas de segurança. Uma das áreas de atuação do Corpo de Bombeiros Militar é o salvamento em alturas, atividade de grande risco desenvolvida em locais de altitudes. O grande problema em atuar nessas áreas é que o indivíduo pode ficar sujeito a indisposição, dores de cabeça, náusea e cansaço devido ao ar rarefeito.
A equação química a seguir representa um sistema em equilíbrio envolvido na transformação da hemoglobina (Hm) em oxiemoglobina (HmO2 ) no sangue:
Hm (aq) + O2 (aq) ⇋ HmO2 (aq)
Sobre o processo de transformação de hemoglobina em oxiemoglobina na ação do profissional bombeiro em diferenças
de altitudes, assinale a alternativa incorreta.