Questões Militares
Comentadas sobre equilíbrio químico em química
Foram encontradas 130 questões
Considere as curvas de solubilidade.
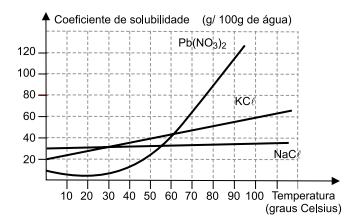
(Estudo gráfico do coeficiente de solubilidade – Manual da Química (manualdaquimica.com))
Ao preparar soluções aquosas com cada um dos sais,
separadamente, dissolvendo 10 g do sal em 50 g de
água a 40 ºC, observa-se formação de corpo de fundo
na solução de
2 H2 S(g) + SO2 (g)
 3 S(s) + 2 H2
O(g); ΔH < 0
3 S(s) + 2 H2
O(g); ΔH < 0 Ocorre o deslocamento do equilíbrio no sentido dos produtos quando, nesse sistema,
 2SO3
(g), uma das etapas de formação do ácido sulfúrico, apresentou os
seguintes valores de pressões parciais à temperatura de
726 ºC.
2SO3
(g), uma das etapas de formação do ácido sulfúrico, apresentou os
seguintes valores de pressões parciais à temperatura de
726 ºC. 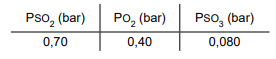
A constante de equilíbrio para esse sistema tem valor de
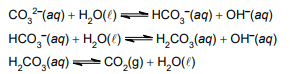
A solução tampão formada nesse sistema envolve o par conjugado ácido-base, nessa ordem:
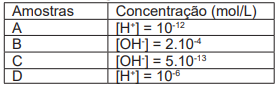
Tabela. Dados de amostras de acordo com suas concentrações hidrogeniônicas e hidroxiliônicas.
Use: log2= 0,3; log5= 0,7 (aproximações)
De acordo com os dados presentes na tabela, assinale a alternativa correta, quanto à acidez, à neutralidade ou à basicidade das amostras A, B, C e D.
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
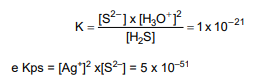
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente:
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
PCl3(g) + Cl2(g) ⇌ PCl5(g) ΔH = −124 kJ/mol
Conforme o princípio de Le Châtelier, o rendimento desse
processo pode ser aumentado
Uma das atividades em que os militares do Corpo de Bombeiros precisam atuar com muita sabedoria é no combate ao incêndio. A exposição dos militares bombeiros ainda é maior em incêndios florestais, uma vez que o uso de equipamentos de proteção fica limitado e os riscos de intoxicação pela fumaça contendo monóxido de carbono são eminentes. O monóxido de carbono tem habilidade de se ligar muito fortemente a hemoglobina (Hb), uma proteína que contém ferro nas células de glóbulos vermelhos. Nessa ligação, forma-se o complexo carboxihemoglobina (COHb). A ligação do oxigênio com a hemoglobina forma a oxihemoglobina(O2Hb).
A respeito do texto descrito, considere o seguinte equilíbrio:
O2Hb (aq) + CO (g)⇌COHb (aq) + O2 (g) K > 1
Do ponto de vista do equilíbrio químico, quando o indivíduo respira muito monóxido de carbono,
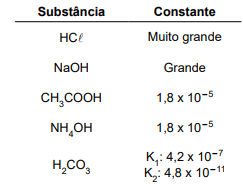
Substância Constante HCl Muito grande NaOH Grande CH3COOH 1,8 x 10–5 NH4OH 1,8 x 10–5 H2CO3 K1 : 4,2 x 10–7 K2 : 4,8 x 10–11

Com base nessas informações, é correto afirmar que: