Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 153 questões
O fósforo sólido (P4), em meio básico, se desproporciona formando o gás fosfina (PH3) e o íon dihidrogenofosfato (H2PO4-). Para cada 2 mols de fósforo (P4) que se desproporciona são consumidos ___________ de íons OH- e são formados ___________ de fosfina e _____________ do íon diidrogenofosfato.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
A seguir são apresentados os resultados de alguns desses experimentos, com as massas de reagentes consumidos e os produtos formados em cada um deles.

Considerando as informações contidas na tabela, os valores de x, y, z e w são, respectivamente,
Pb(NO3)2 + 2KI → PbI2 + 2KNO3 CH3NH2 + HI → CH3NH3I PbI2 + CH3NH3I → CH3NH3PbI3
Os seguintes reagentes foram empregados na síntese: 0,6 mol de Pb(NO3)2; 0,8 mol de KI; 0,7 mol de CH3NH2; e 0,8 mol de HI. Nessas condições, qual será a quantidade máxima da perovskita CH3NH3PbI3 produzida?
Adaptado. Disponível em: Cobre: Ocorrência, obtenção industrial, propriedades e utilização - UOL Educação. Acesso: 05 de janeiro de 2022.
Um dos minérios mais utilizados na obtenção do cobre metálico é a calcosita, que pode ser representada pela fórmula Cu2 S. Um método de retirada do enxofre do minério é o processo de ustulação (por meio de aquecimento em presença de ar seco, rico em gás oxigênio). Observe a equação não balanceada a seguir, que representa o processo citado anteriormente:
Cu2S + O2 → Cu + SO2
Após o balanceamento da equação anterior, assinale a alternativa que apresenta qual é a massa aproximada (em gramas) de cobre metálico que pode ser obtida a partir de 2,0 Kg de Cu2S, com 60% de pureza e gás oxigênio suficiente. (Dados: massas atômicas - Cu = 63,5; S = 32).
Massa molar: O=16 g/mol; H=1 g/mol; C=12 g/mol.
a KMnO4 + b FeSO4 + c H2SO4 → d Fe2(SO4)3 + e K2SO4 + f MnSO4 + g H2O
A soma dos coeficientes estequiométricos (a + b + c + d + e + f + g) que tornam a equação balanceada é igual a
As reações de ustulação são processos inorgânicos que podem dar origem a produtos como metais puros e óxidos metálicos. Nessas reações, sulfetos são submetidos a uma reação de combustão conforme disposto no exemplo a seguir:
x FeS2(g) + y O2(g) → zFe3O4(s) + w SO2(g)
Os números que representam corretamente os coeficientes estequiométricos x, y, z e w são, respectivamente,
Quando se acrescenta ácido sulfúrico, H2SO4 (aq), a uma suspensão de hidróxido de alumínio, Al(OH)3 (s), ocorre a reação representada pela equação, não balanceada:
Al(OH)3 (s) + H2SO4 (aq) Al2 (SO4)3 + H2O (l)
Os coeficientes estequiométricos que preenchem, respectivamente, as lacunas da equação e a tornam corretamente balanceada são:
Leia os textos a seguir e resolva a questão:
“Nas equações químicas, tanto as substâncias transformadas (reagentes) como as produzidas são representadas por fórmulas. As fórmulas das substâncias indicam elementos que as constituem e, também, a quantidade de átomos de cada elemento. O número que indica essa quantidade de átomos é chamado índice, que é anotado à direita do símbolo de cada elemento. (...)
A quantidade de cada substância que participa da reação é indicada por números escritos antes de suas fórmulas, denominados coeficientes estequiométricos, que devem ser os menores números inteiros possíveis.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 1: Química Geral. p. 385.
“Em uma reação de oxidorredução, o mais comum é que uma espécie se oxide e outra se reduza. Porém, podem ocorrer casos com duas ou mais oxidações e apenas uma redução ou viceversa. De qualquer maneira, para o balanceamento desse tipo de reação, o princípio é sempre o mesmo: n° de elétrons perdidos = n° de elétrons recebidos.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 2: Físico-Química. p. 250.
Considere a seguinte equação de reação química de oxidorredução não balanceada:
As2S3 + NH4OH + H2O2 → (NH4)3AsO4 + (NH4)2SO4 + H2O
Acerca desta reação química de oxidorredução e de suas espécies, são feitas as seguintes afirmativas:
I – O peróxido de hidrogênio é o agente redutor.
II – Após o devido balanceamento, o coeficiente estequiométrico da água é 20.
III – O arsênio da substância As2S3 é reduzido, enquanto o enxofre é oxidado.
IV – O (NH4)2SO4 é um sal cujo nome é sulfito de amônio.
V – Após o devido balanceamento, a soma de todos os coeficientes estequiométricos da equação é igual a 52.
Das afirmativas feitas, estão corretas apenas
Em química orgânica existem várias apresentações de fórmulas, como fórmulas moleculares e percentuais. A fórmula molecular indica o número de átomos de cada elemento em uma molécula da substância. A fórmula percentual indica a porcentagem, em massa, de cada elemento que constitui a substância. Uma maneira de determinação dessa fórmula é a partir da fórmula molecular, aplicando-se conceitos de massa atômica e massa molecular.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 114
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; 3-metilbutanal e 2-metilbutanal.
Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua
fórmula percentual, aproximadamente 54,5 % em massa de carbono (C) na sua estrutura é o
O fósforo branco, substância química cuja estrutura é representada pela fórmula P4 , é utilizado em algumas munições fumígenas (munições que produzem fumaça). Ele pode ser obtido a partir da fosforita (Ca3(PO4)2), um mineral de fosfato de cálcio, por meio da reação com sílica (dióxido de silício - SiO2) e carvão coque (C) num forno especial a 1300 ºC.
A equação não balanceada da reação é:
Ca3(PO4)2 (s) + SiO2 (s) + C (s) → CaSiO3 (s) + CO (g) + P4 (s)
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular.
III – O agente redutor do processo é o dióxido de silício.
IV – Neste processo ocorre a oxidação do carbono.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Devido ao intenso calor liberado, reações de termita são bastante utilizadas em aplicações militares como granadas incendiárias ou em atividades civis como solda de trilhos de trem. A reação de termita mais comum é a aluminotérmica, que utiliza como reagentes o alumínio metálico e o óxido de ferro III.
A reação de termita aluminotérmica pode ser representada pela equação química não balanceada:
Al (s) + Fe2O3 (s) → Fe (s) + Al2O3 (s) + Calor
Dados: valores arredondados de entalpias padrão de formação das espécies ∆Ho fAl2O3 = - 1676 kJ/ mol; ∆Ho f Fe2O3 = - 826 kJ/mol
Acerca desse processo, são feitas as seguintes afirmativas:
I – Após correto balanceamento, o coeficiente do reagente alumínio na equação química é 2.
II – Essa é uma reação de oxidorredução e o agente oxidante é o óxido de ferro III.
III – Na condição padrão, o ∆H da reação é - 503 kJ para cada mol de óxido de alumínio produzido.
IV – Na condição padrão, para a obtenção de 56 g de ferro metálico, o calor liberado na reação é de 355 kJ.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
A combustão completa do eicosano, um dos componentes da parafina utilizada para formar velas, é representada pela seguinte equação, não balanceada:
___ C20H42 + ___ O2 → ___ CO2 + ___H2O
Nessa equação, quando o coeficiente estequiométrico do
eicosano for 2, o do oxigênio será
A sim-trimetilenotrinitramina (C3 H6 N6 O6 ), também conhecida como RDX ou ciclonita, é um poderoso explosivo utilizado na fabricação de minas, cargas de profundidade e em torpedos, entre outros.
Sua estrutura química é apresentada a seguir.
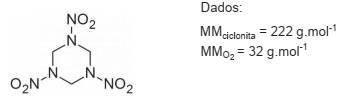
A detonação de um explosivo é uma reação de oxidação, provocada por impacto ou por ação do calor. Quando a quantidade de oxigênio presente na molécula do explosivo é insuficiente para que a oxidação completa ocorra, parte do oxigênio provém de fontes externas, como o ar atmosférico. O balanço de oxigênio para a molécula de explosivo fornece a fração de oxigênio, em percentual mássico, insuficiente ou excedente, que a molécula apresenta relativamente à quantidade necessária para a sua oxidação completa.
No caso da ciclonita, esse percentual é de