Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 153 questões
Com relação a reações químicas e a substâncias, julgue o item subsequente.
No balanceamento de uma equação química, o número
de substâncias no reagente tem que ser igual ao número
de substâncias no produto.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Nas moléculas, os átomos das substâncias são organizados
linearmente de acordo com sua fórmula molecular.
Na ânsia pelo "elixir da longa vida", por volta do século I, alquimistas descobriram acidentalmente a Pólvora, referenciada em textos de Alquimia pelos avisos quanto aos cuidados para não se misturarem certos materiais uns com os outros. A pólvora, mais conhecida desde o final do século XIX como pólvora negra, é uma mistura química que queima com rapidez. Foi extensamente utilizada como propelente em canhões e armas de fogo e atualmente ainda é empregada em artefatos pirotécnicos. Nitrato de potássio, enxofre e carvão (carbono) são os constituintes da pólvora negra. Sobre as espécies constituintes da pólvora negra afirma-se que
Dados:
Número Atômico: K = 19; N = 7; O = 8; S = 16; C = 6
I - o nitrato de potássio é classificado como uma base segundo a teoria de Arrhenius;
II - a 25 °C e 1 atm a variedade alotrópica mais estável do carbono é a grafite e a do enxofre é a rômbica;
III - a fórmula do nitrato de potássio é KNO2 ;
IV - o enxofre é um metal radioativo que pertence à família 6A (16) da tabela periódica;
V - o átomo de carbono (6C) estabelece 4 ligações químicas e possui a variedade alotrópica diamante, substância natural de alta dureza;
Estão corretas apenas as afirmativas
A emissão de gases derivados do enxofre, como o dióxido de enxofre (SO2), pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico (CO2), potencializando o efeito poluente. Considerando as equações das reações sucessivas a 27 °C e 1 atm, admitindo-se os gases como ideais e as reações completas, o volume de CO2 produzido a partir da utilização de 2 toneladas de SO2 como reagente é, aproximadamente,
Dados
Massas Atômicas: S = 32 u ; O = 16 u ; H = 1 u ; C = 12 u ; Ca = 40 u
Constante dos gases ideais: R = 0,082 atm L
L mol-1
mol-1 K-1
K-1
Volume molar nas condições em que ocorreu a reação (27° e 1 atm) = 24,6 L/mol
SO2 (g) + 1/2 O2 (g) → SO3 (g) (equação I)
SO3 (g) + H2O (ℓ) → H2SO4 (ℓ) (equação II)
H2SO4 (ℓ) + CaCO3 (s) → CaSO4 (s) + H2O (ℓ) + CO2 (g) (equação III)
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
Leia as informações da tabela a seguir que representa alguns ácidos e suas aplicações.
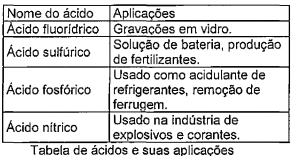
As fórmulas dos ácidos citados na tabela acima são,
respectivamente:
CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
CONSTANTES

DEFINIÇÕES


Determine a concentração, em mol .L -1, de íons potássio [k+] em uma solução de 800ml, com 34,8g de sulfato de potássio (K2SO4) . Assinale, a seguir, a opção correta .
Dados: K = 39 g . mol-1
S = 32 g . mol-1
O = 16 g.mol-1
Observe a equação a seguir.

Assinale a opção que apresenta os valores dos coeficientes que
deixarão a equação acima balanceada.
A fermentação da glicose (C6H12O6) produz álcool etílico (C2H5OH) , que no Brasil é utilizado como combustível. A equação abaixo representa esse processo.
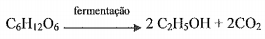
Assinale a opção que apresenta a quantidade de gramas de álcool etílico que é produzida a partir da fermentação de 18 Kg de glicose.
Dados : H= 1 g/mol
C= 12 g/mol
O= 16 g/mol
0 tricloreto de fósforo (PCI3) pode ser preparado a partir da reação do fósforo branco (P4) com o cloro gasoso (CI2), de acordo com a equação a seguir

Assinale a opção que apresenta a quantidade de gramas de cloro gasoso que é necessária para reagir com 310 gramas de fósforo branco.
Dados : P = 31 g/mol
Cl = 35,5 g / mol .