Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 157 questões
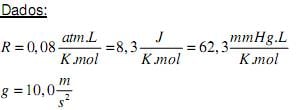
Cu (s) + HNO3 (aq) → Cu(NO3)2 (aq) + NO (g) + H2O (l)
Após o balanceamento da equação com os coeficientes estequiométricos (menores números inteiros) a soma destes coeficientes será igual a
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
Dados:
Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1 .
Baseado nessa reação, são feitas as seguintes afirmativas:
I – O sódio atua nessa reação como agente redutor.
II – A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III – Os dois produtos podem ser classificados como substâncias simples.
IV – Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
CaCO3 → CaO + CO2
Quando a produção de CO2 é de 220g, a produção, em gramas, de CaO é
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
A reação de decomposição do NH4NO3 (s) está corretamente balanceada na equação 8NH4NO3 (s) → 4NH3 + 8N2O (g) + 4NO2 (g) + 10H2O (l) + O2 (g).
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
O NH4NO3, um sal cuja nomenclatura é nitrato de amônio, pode ser sintetizado a partir da reação de neutralização do ácido nítrico com amônia
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.
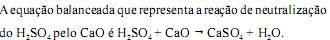
A corrosão de objetos metálicos é acelerada em meio ácido. Supõe-se ter sido esse fator preponderante para o trágico desabamento de parte das arquibancadas do estádio da Fonte Nova, em Salvador – BA, em 2007, que causou a morte de 8 pessoas. Os torcedores tinham o hábito de urinar nas arquibancadas do estádio.
Como a estrutura de concreto é porosa, a urina, que contém ácidos e sais, penetrava e atingia a estrutura de ferro do estádio, o que causou a sua corrosão.
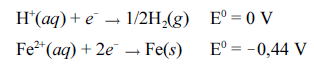
Tendo como base essas informações e considerando os potenciais padrão (E0) fornecidos para as semirreações acima, julgue o item subsequente.
A reação balanceada que representa a corrosão de uma peça de ferro pelo íon
H+ é H+(aq) + Fe(s)  1/2H2(g) + Fe2+(aq).
1/2H2(g) + Fe2+(aq).

