Questões Militares
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 148 questões
CaC2O4 (s) ➝ CaCO3 (s) + CO (g) CaCO3 (s) ➝ CaO (s) + CO2 (g)
O resultado da análise é apresentado na forma de uma curva da variação de massa em função da temperatura ao longo do processo de aquecimento.
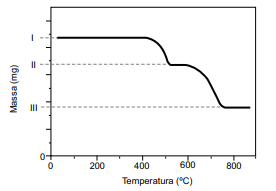
(Cavalheir, E. T. G.; et al. Química Nova. Adaptado)
I. 51,2 mg da amostra da mistura de CaC2 O4 e SiO2 . II. 42,8 mg. III. 29,6 mg.
O teor de oxalato de cálcio nessa amostra é de
Considerando que a reação cessa após o consumo total do reagente limitante, ao serem misturados 12 mol de cada um dos reagentes, a quantidade máxima de fosfeto de boro que pode ser formada e a quantidade total de reagentes que permanecem sem reagir são, respectivamente,
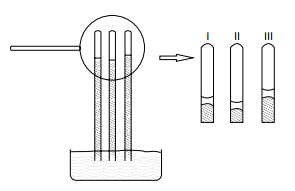
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
O ânion perxenato (XeO6 4- ) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
5 Na4XeO6(aq) + 8 MnSO4(aq) + 2 H2O(l) → 5 Xe(g) + 8 NaMnO4(aq) + 6 Na2SO4(aq) + 2 H2SO4(aq)
Além disso, o XeO6 4- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
A combustão completa do eicosano, um dos componentes da parafina utilizada para formar velas, é representada pela seguinte equação, não balanceada:
___ C20H42 + ___ O2 → ___ CO2 + ___H2O
Nessa equação, quando o coeficiente estequiométrico do
eicosano for 2, o do oxigênio será
Com o avanço crescente da violência nas grandes cidades, o uso de armas não letais pelas polícias e forças armadas, no intuito de dispersar ou controlar multidões em protestos ou manifestações violentas, vem crescendo cada vez mais no Brasil. Entre essas armas, os compostos lacrimogêneos destacam-se como um poderoso agente, provocando irritação nos olhos, acompanhada por lacrimação, assim como irritações na pele e nas vias respiratórias. Os lacrimogêneos são constituídos de três compostos que são utilizados separadamente: o cloroacetofenona (CN), o 2-clorobenilideno malononitrila (CS) e dibenz-1:4-oxazepina (CR).
A seguir estão representadas as estruturas desses três compostos:
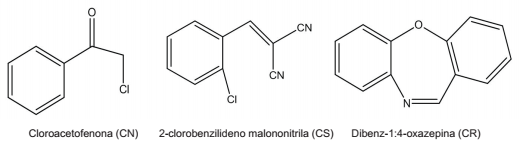
Sobre esses compostos, foram feitas as seguintes afirmativas:
I. Um mol de molécula do composto CN tem 5 pares de elétrons não ligantes.
II. Um mol de molécula do composto CS tem 4 ligações pi.
III. Um mol de molécula do composto CR tem 9 mols de átomos de hidrogênio.
IV. Somente o composto CS tem mais de um carbono primário.
Estão corretas as afirmativas
O módulo de descida lunar da Apoio utilizou a dimetil-hidrazina (CH3)2NNH2 como combustível juntamente com o N2O4 líquido como oxidante. A reação química entre os dois reagentes no motor do foguete ocorre conforme descrito na equação química balanceada a seguir:
(CH3)2NNH2 + 2N2O4 → 4H2O + 2CO2 + 3N2

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
A respeito da matéria e de sua constituição química, julgue o item a seguir.
A massa molecular das substâncias é dada pela soma das
massas de todos os átomos que constituem suas moléculas
ou fórmulas mínimas.
A respeito da matéria e de sua constituição química, julgue o item a seguir.
O mol é a unidade de medida da grandeza quantidade
de matéria.
A emissão de gases derivados do enxofre, como o dióxido de enxofre (SO2), pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico (CO2), potencializando o efeito poluente. Considerando as equações das reações sucessivas a 27 °C e 1 atm, admitindo-se os gases como ideais e as reações completas, o volume de CO2 produzido a partir da utilização de 2 toneladas de SO2 como reagente é, aproximadamente,
Dados
Massas Atômicas: S = 32 u ; O = 16 u ; H = 1 u ; C = 12 u ; Ca = 40 u
Constante dos gases ideais: R = 0,082 atm L
L mol-1
mol-1 K-1
K-1
Volume molar nas condições em que ocorreu a reação (27° e 1 atm) = 24,6 L/mol
SO2 (g) + 1/2 O2 (g) → SO3 (g) (equação I)
SO3 (g) + H2O (ℓ) → H2SO4 (ℓ) (equação II)
H2SO4 (ℓ) + CaCO3 (s) → CaSO4 (s) + H2O (ℓ) + CO2 (g) (equação III)
“Certo gás em temperatura de 27°C e 1 atm, dentro de um recipiente isotérmico, sofreu uma variação em sua pressão, passando a ser 1,5 atm.”
Assinale a alternativa que corresponde à quantidade de mols existente dentro do recipiente.
(Dados: V = 22,4L; R = 0,082 atm. L / mol . K.)
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?