Questões Militares de Química - Interações Atômicas: Geometria Molecular, Polaridade da ligação e da Molécula, Forças Intermoleculares e Número de Oxidação.
Foram encontradas 111 questões
Analise os complexos abaixo.
I- [Fe(CN)6]4-
II- [Fe(CN)6]3-
III- [Cu(NH3)4]2+
IV- [Cu(CN)4]3-
O número de coordenação em cada um dos complexos acima é, respectivamente:
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
Entre os produtos da reação química apresentada, podem ser
identificadas uma substância iônica e duas substâncias
moleculares; entre as substâncias moleculares, uma é polar e,
a outra, apolar.
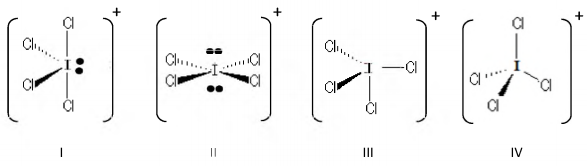
Assinale a alternativa que apresenta, respectivamente, a estrutura do íon ICl4+ e o tipo de hibridização de seu átomo central.
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II - o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV - o CO é um óxido básico que, ao reagir com água, forma uma base;
V - a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
O trecho “por ser capaz de transpor facilmente membranas celulares”
destaca a característica predominantemente apolar do peróxido de
hidrogênio.
Analise os compostos a seguir de acordo com suas propriedades de ligação entre moléculas.
I. Metano.
II. Monóxido de carbono.
III. Ácido clorídrico.
IV. Gás cloro.
As alternativas que contêm somente moléculas apolares são:
CONSTANTES

DEFINIÇÕES


Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+ .
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
Assinale a opção que apresenta as espécies que sofrem oxidação e redução, respectivamente, na reação a seguir:
CuS(s) + o2(g) Cu(s) + So2(g)
As moléculas ΦOF4, ΨF4 e ΩF5 apresentam, respectivamente, formas geométricas que se aproximam das figuras (1), (2) e (3), mostradas a seguir, no modelo de bola e palito:
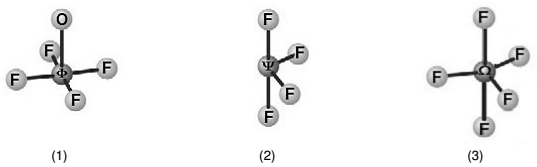
Sabendo-se que “Φ“, “Ψ” e “Ω” representam elementos da tabela periódica, assinale a alternativa correta que indica, na sequência, as possíveis identidades destes elementos: