Questões Militares
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 107 questões
Algumas bactérias do solo, como as nitrobactérias, catalisam a oxidação do nitrogênio contido em sais de amônio (fertilizante químico) formando nitrato, o qual pode ser assimilado pelos vegetais.
2O2 + NH4+ → NO3- + 2H+ + H2O
É correto afirmar que o nitrogênio presente no
ânion nitrato apresenta um número de oxidação
(Nox) de:
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
O trecho “por ser capaz de transpor facilmente membranas celulares”
destaca a característica predominantemente apolar do peróxido de
hidrogênio.
Considere as seguintes afirmações a respeito dos haletos de hidrogênio HF HCl HBr e HI :
I. A temperatura de ebulição do HI é maior do que a dos demais. I
I. À exceção do HF ,os haletos de hidrogênio dissociam-se completamente em água.
III. Quando dissolvidos em ácido acético glacial puro, todos se comportam como ácidos, conforme a seguinte ordem de força ácida: HI > HBr > HCl >> HF
Das afirmações acima, está(ão) CORRETA(S) apenas
Todos os átomos da molécula do monômero cloreto de vinila se encontram em um mesmo plano.
A tabela abaixo apresenta alguns dos produtos químicos existentes em uma residência.
Assinale a alternativa correta:
A Tabela II mostra os elementos químicos (H, F, Cl, Br e I) e suas respectivas massas atômicas.
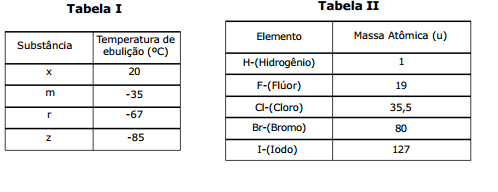
Com base nas Tabelas acima, são feitas as seguintes afirmações:
I- As substâncias correspondentes a x, m, r e z são, respectivamente, HF, HI, HBr e HCl.
II- As moléculas de HCl, HBr e HI são unidas por forças do tipo pontes ou ligações de hidrogênio.
III- Das substâncias em questão, o HI apresenta a maior temperatura de ebulição, tendo em vista possuir a maior massa molar.
Das afirmações feitas, está(ão) correta(s) apenas:
Da análise da estrutura do dióxido de carbono (CO2) , conclui-se que, apesar de a ligação entre C e O ser polar, a molécula é apolar pelo fato de sua geometria ser linear.
O fato de o carbono na molécula de CO2 apresentar estado de oxidação o mais reduzido possível corrobora a informação mencionada no texto de que essa substância não atua como combustível.
É provável que muitos alunos conheçam a clássica questão: “o que pesa mais, um quilo de chumbo ou um quilo de algodão?” Na verdade, eles têm a mesma massa, porém, os volumes que ocupam é que são diferentes.
A propriedade dessas matérias em que o
chumbo tem a sua massa contida em um
pequeno volume, enquanto o algodão tem sua
massa ocupando um grande volume, é definida
pela(o):
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Marque a resposta certa, corresponde aos números de oxidação dos elementos sublinhados em cada fórmula, na ordem em que estão apresentados.
AgO; NaO2; H2S2O8; Ni(CO)4; U3O8
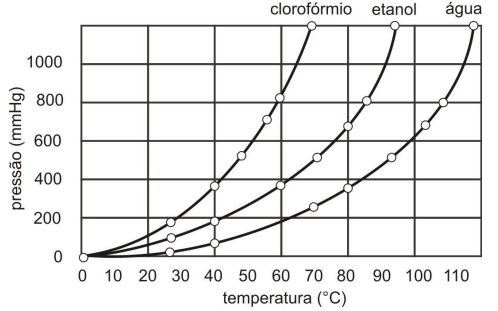
De acordo com o gráfico, é CORRETO afirmar que
I. A fusão do enxofre elementar,S8(s) produz moléculas S8
II. Sílica, (SiO2)n é um exemplo de sólido molecular.
III. A fusão da sílica, (SiO2)n, ocorre com quebra das ligações Si-O.
IV. Sólidos iônicos são bons condutores de eletricidade.
V. As partículas formadoras dos sólidos metálicos são átomos.
I. A molécula I2 é mais polarizável que Cl2
II. O momento de dipolo de HI é maior que o de HCl.
III. O cátion Na+ é mais polarizante que Li+
IV. O caráter covalente no cloreto de lítio é maior que no cloreto de sódio.
V. As forças intermoleculares entre Cl2 são mais intensas que entre I2-
PF5. SF4, SF6, SO42-, NO2, HCN, BF4-
Com relação a essas espécies pode-se afirmar que: