Questões Militares Sobre química
Foram encontradas 2.062 questões
No estado padrão, é de 0,240 V o potencial da pilha cuja reação pode ser descrita pela seguinte equação química:
2 NO + ½ O2 + H2O → 2 HNO2.
Assinale a alternativa que apresenta o valor da energia livre padrão da reação, em kJ·mol-1.
Considere a reação descrita pela seguinte equação química:
H2(g, 1bar) + 2AgBr(s) → 2H+ (aq) + 2Br−(aq) + 2Ag(s).
Sendo X o potencial padrão (E°) da reação, o pH da solução a 25 °C quando o potencial da reação (E) for Y
será dado por
Considere os seguintes compostos químicos que se encontram no estado líquido à temperatura de 298 K e pressão ambiente de 1 bar:
I. 2-metil-pentano
II. 3-metil-pentano
III. 2,2-dimetil-butano
IV. 2,3-dimetil-butano
V. Hexano
Nestas condições, assinale a opção que apresenta a ordem decrescente da magnitude da pressão de vapor dos
respectivos compostos.
I. Para reações bimoleculares, o fator pré-exponencial na equação de Arrhenius é proporcional à frequência de colisões, efetivas ou não, entre as moléculas dos reagentes.
II. O fator exponencial na equação de Arrhenius é proporcional ao número de moléculas cuja energia cinética relativa é maior ou igual à energia de ativação da reação.
III. Multiplicando-se o negativo da constante dos gases (−R) pelo coeficiente angular da reta ln k versus 1/T obtém-se o valor da energia de ativação da reação.
IV. O fator pré-exponencial da equação de Arrhenius é determinado pela intersecção da reta ln k versus 1/T com o eixo das abscissas.
Das proposições acima, está(ão) ERRADA(S)
I - Método com base na densidade.
II - Método com base no tamanho das partículas.
III- Método com base nas temperaturas de ebulição.
As definições acima se referem, respectivamente, a:
Analise a tabela abaixo, considerando os pontos de fusão (PF) e ebulição (PE), a 1 atm de pressão, das substâncias a seguir.
Substância PF (°C) PE (°C)
Cloro - 101,0 - 34,6
Flúor - 219,6 - 188,1
Bromo - 7,2 58,8
Mercúrio - 38,8 356,6
Iodo 113,5 184
Sendo assim, é correto afirmar que, a 50°C, encontram-se no
estado líquido:
ISÓTOPO ABUNDÂNCIA (%)
Fe54 5, 845
Fe56 91,754
Fe57 2,119
Fe58 0,282
Com relação às informações acima, analise as afirmativas abaixo.
I - A massa atômica do ferro a ser representada na tabela periódica deve se aproximar de 58.
II - Nesses isótopos o número de prótons é constante.
III- Esses isótopos são caracterizados por diferentes números de camadas eletrônicas nos átomos, no estado fundamental.
Assinale a opção correta.
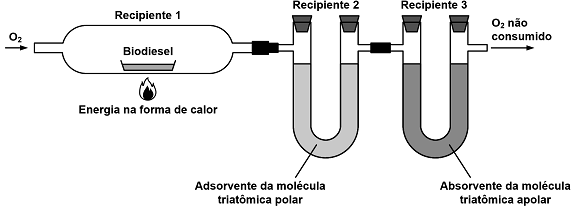
Nesse processo foram admitidos 264,0 g de oxigênio, sendo rejeitados, na forma de oxigênio não consumido, 88,0 g. Observou-se ainda, no recipiente 2, um acréscimo de massa de 68,4 g e no recipiente 3, um acréscimo de massa de 167,2 g.
A alternativa que apresenta a fórmula molecular do biodiesel compatível com as informações apresentadas anteriormente é
(Massas molares: H = 1 g/mol; O = 16 g/mol; C = 12 g/mol)
HClO + NaOH → NaClO + H2O
É teoricamente possível obter os reagentes por meio da
Entre as alternativas abaixo, a única que pode corresponder aos compostos A, B e C, respectivamente, é
(Massa molar: Mg = 24,31 g/mol)

Com base nestes dados, e sabendo que HA tem constante de ionização igual a 4,0 x 10−10, é coerente afirmar que o indicador HA
(Dado: log 4 = 0,6)