Questões Militares de Química - Química Orgânica
Foram encontradas 374 questões
O composto orgânico oxigenado, X, reage, em condições adequadas, de acordo com as equações de reação representadas a seguir.
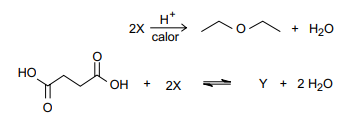
O composto Y tem a seguinte fórmula molecular:
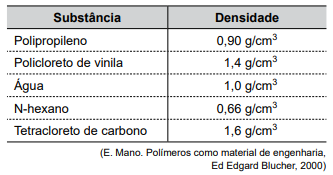
Na tabela a seguir são apresentadas as densidades de três sólidos poliméricos e de três líquidos.
A figura seguinte representa o resultado da mistura de algumas amostras das substâncias apresentadas na tabela.
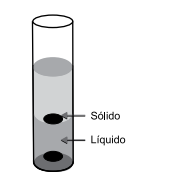
Considerando que não ocorreu reação entre os componentes do experimento, o sólido e o líquido indicados
pelas setas são, correta e respectivamente:
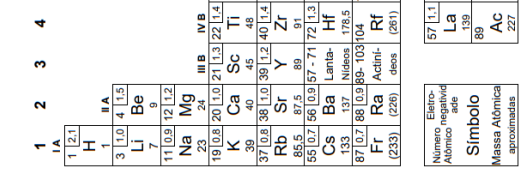
Considere as massas atômicas C: 12g mol–1, H: 1g mol–1 e O: 16gmol–1.
A massa molecular do ácido oxálico, em g mol–1, é


A esse respeito, analise as afirmativas a seguir.
I. Em pressão atmosférica, o ponto de fusão do benzeno é maior que 25ºC.
II. Em temperatura superior a 80ºC e pressão atmosférica, o benzeno estará no estado gasoso.
III. A evaporação de benzeno ocorre apenas em temperatura acima de 80ºC, logo não há risco de inalação de vapores em temperatura ambiente.
Está correto o que se afirma em
– O composto A possui fórmula molecular C3H6.
– O composto B é o produto majoritário da reação de adição do ácido bromídrico em A (A + HBr → B).
– O composto C é o produto orgânico de substituição da reação entre B e hidróxido de potássio (B + KOH → C).
Com base nessas informações, os compostos A, B e C são, respectivamente:
1. Aminas e amidas são funções orgânicas hidroxiladas.
2. Éteres e ésteres são funções orgânicas nitrogenadas.
3. Fenóis e álcoois são funções orgânicas oxigenadas.
4. Cetonas e aldeídos são funções orgânicas carboniladas.
De acordo com os conhecimentos de química orgânica, a(s) afirmativa(s) que descreve(m) corretamente as características estruturais das funções orgânicas citadas é/são:

Considerando as informações acerca da estrutura do propilenoglicol e os conhecimentos em química orgânica, é correto afirmar que esse composto:
A vanilina é um composto orgânico extraído da semente de baunilha e que é bastante utilizado como agente aromatizante em bebidas e alimentos. Sua fórmula estrutural está representada a seguir:

As funções orgânicas presentes em sua estrutura são
Observe a cadeia carbônica a seguir e classifique-a respectivamente quanto à disposição dos átomos, quanto aos tipos de ligações, quanto à presença de heteroátomos e quanto à presença de ramificação:
H3C– C(CH3)2–CH2– C–O–CH2–CH3
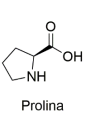
Considerando os conhecimentos em química orgânica, a prolina é classificada como:

I. A reação do metil benzeno com o ácido sulfúrico fumegante é mais rápida comparada à reação do benzeno nas mesmas condições experimentais.
II. A reação de nitração do metil benzeno produz preferencialmente compostos orto- e parasubstituídos.
III. A nitração do benzeno é mais rápida do que a nitração do nitrobenzeno, a qual requer uma maior concentração de ácido nítrico e uma temperatura maior.
IV. O único produto resultante da reação de nitração do 1-hidroxi-4-metil-benzeno é o 1-hidroxi-2-nitro4-metil-benzeno.
V. A reação de nitração do ácido benzoico produz preferencialmente o composto meta-substituído.
Assinale a opção que contém as afirmações CORRETAS:

I. Os aminoácidos são pequenas moléculas com propriedades bioquímicas únicas determinadas por seus grupos funcionais.
II. Os aminoácidos em pH fisiológico (~7,4) apresentam os grupamentos amina protonados, enquanto os grupos carboxílicos assumem sua forma de base conjugada.
III. Os aminoácidos podem se polimerizar por meio de reações de adição para formar as ligações peptídicas (CO-NH).
IV. As variações no comprimento e sequência de aminoácidos de polipeptídios são características que contribuem para a diversidade na forma e nas funções biológicas das proteínas.
V. Todos os aminoácidos obtidos de polipeptídios são opticamente ativos, isto é, eles desviam o plano da luz polarizada.
Assinale a alternativa que apresenta as afirmações CORRETAS.

I. Água e metanol.
II. Acetona e dissulfeto de carbono.
III. Acetona e clorofórmio.
IV. n-hexano e n-heptano. V. Metanol e etanol.
Assinale a alternativa que apresenta os pares de substâncias que formam soluções consideradas ideais.
A estrutura química da Zidovudina é representada a seguir:
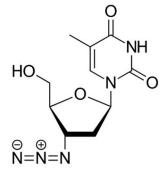
Se considerados apenas os grupos oxigenados na estrutura do AZT, estão presentes no medicamento Zidovudina os grupos funcionais
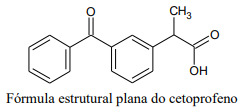
Nessa molécula, pode-se observar as seguintes funções orgânicas:
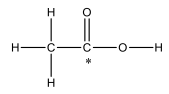
Nessa estrutura, há:
Nessa molécula, pode-se observar as seguintes funções orgânicas:
Um dos equipamentos essenciais utilizados pelo militar do Corpo de Bombeiros é o capacete de segurança. O capacete é feito para proteção integral do crânio e da face contra os choques mecânicos, as chamas e o calor. Sua estrutura externa é moldada em poliamida, um polímero de cadeia longa que contém o grupo amida.
O grupo funcional que faz parte da constituição química da poliamida é o:
Leia o texto a seguir e resolva a questão:
“A ozonólise utiliza ozônio (O3) na presença de água (H2O) e zinco (Zn). O ozônio adiciona-se à dupla ligação do alqueno, originando um composto intermediário instável, denominado ozoneto ou ozonida. O ozoneto, por sua vez, se hidrolisa, originando aldeídos e/ou cetonas. A finalidade da utilização do zinco é evitar que o oxigênio, que pode ser produzido pela decomposição da água oxigenada, oxide o aldeído, transformando-o em ácido carboxílico.”
Fonte: modificado de USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 3: Química Orgânica. p. 348.
Sabe-se que a ozonólise de um alqueno genérico denominado A, produziu os compostos propanona e propanal como produtos, além da substância H2O2.
A + O3 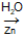 propanona + propanal + H2O2
propanona + propanal + H2O2
Acerca desta reação e de seus reagentes e produtos, são feitas as seguintes afirmativas:
I – De acordo com a IUPAC, o nome oficial da substância A é 2-metilpent-2-eno.
II – O nome da substância H2O2 é superóxido de hidrogênio.
III – O grupo orgânico carbonila está presente nas três substâncias orgânicas (substância A, propanona e propanal).
IV – Os compostos A, propanona e propanal têm em sua estrutura ao menos um carbono com hibridização sp2 .
V – A cadeia carbônica da substância A é ramificada.
Das afirmativas feitas, estão corretas apenas