Questões Militares
Sobre química orgânica em química
Foram encontradas 355 questões

O composto 1 apresenta duas aminas terciárias.

O nome do composto 2 é etano-1,2-diol.
Dados: fórmulas moleculares: metano: CH4; propano: C3H8; butano: C4H10; etanol: C2H6O; e metanol: CH4O.
Considerando a reação de combustão completa desses combustíveis, o que necessitará de maior quantidade de gás oxigênio por molécula de combustível é o
ÂNGELIS, R. Descubra a importância da química forense. http://www.ung.br/noticias/descubra-importancia-da-quimica-forense. Acesso em 10/06/2020. Adaptado.
Dados: massas atômicas (u): H = 1, C = 12, N = 14 e O = 16.
A substância detectada possuía massa molecular 162; portanto, é possível saber que se tratava da
As aminas de cadeia curta, como as mostradas a seguir, possuem cheiro rançoso e desagradável, semelhante ao odor de peixe.
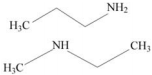
A intensidade do cheiro depende fundamentalmente da estrutura
da molécula, ainda que a fórmula molecular seja a mesma. Isso
decorre do fenômeno da isomeria, que, no caso das aminas em
apreço, é do tipo


As ligações entre esses aminoácidos são feitas por átomos que pertencem ao seguinte elemento químico:

O Brasão de Armas do Brasil, também conhecido como Brasão da República, é um importante símbolo da República Federativa do Brasil. Ele é constituído de um escudo azul-celeste, apoiado sobre uma estrela de cinco pontas, disposta na forma da constelação do Cruzeiro do Sul. Ao seu redor, está uma coroa formada de um ramo de café frutificado e outro de fumo florido sobre um resplendor de ouro.
BRASIL. Presidência da República. Disponível em:
<http://www2.planalto.gov.br/mandatomicheltemer/conheca-a-
presidencia/acervo/simbolos-nacionais/brasao>.
Acesso em: 13 ago. 2020 (Adaptação).
Pela importância econômica para o Brasil, as folhas de café e de tabaco foram incorporadas no Brasão da República. Nas folhas de tabaco sempre se encontra a nicotina, uma substância carcinogênica e nas folhas de café, a cafeína, uma substância estimulante do sistema nervoso central. A estrutura química da nicotina e da cafeína são representadas a seguir.
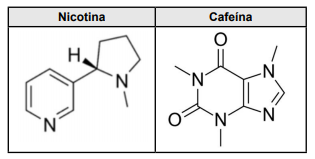
Sobre algumas propriedades químicas das estruturas,
é correto afirmar que
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O ponto de fusão do argônio é menor que o do xenônio em uma mesma pressão. (2) A pressão de vapor do dimetilpropano é maior que a do pentano. (3) O valor absoluto da energia potencial de interação entre a molécula de água e o Ca2+ é menor do que entre a molécula de água e o Al3+ . (4) O valor absoluto da energia potencial de interação entre a molécula de água e o Ga3+ é maior do que entre a molécula de água e o Al3+ .
A soma dos números associados às proposições ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. Penteno e ciclopentano não são isômeros estruturais, enquanto butano e ciclobutano são. II. Cloroeteno pode sofrer polimerização por adição, enquanto o tetrafluoretano não. III. 2-Bromopropano é opticamente ativo, enquanto 1,2-dicloropentano não é. IV. Sob exposição à luz, a reação entre cloro e metano ocorre por substituição. Por outro lado, na ausência de luz, a reação entre bromo e eteno ocorre por adição. V. A desidratação intramolecular de álcoois orgânicos forma alcenos.
Das afirmações acima, está(ão) CORRETA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

O processo de obtenção sustentável do monômero é corretamente representado em:
O ácido etanoico, também denominado usualmente de ácido acético, é um ácido orgânico e uma das substâncias componentes do vinagre. Considerando-se a substância ácido etanoico, pode-se afirmar que:
I – É um composto cuja fórmula molecular é C2H6O.
II – Possui apenas ligações covalentes polares entre seus átomos.
III – Possui um carbono com hibridização sp2.
IV – Possui dois carbonos assimétricos (quiral).
V – O anidrido etanoico (acético) é isômero de cadeia do ácido etanoico (acético).
VI – Pode ser obtido pela oxidação enérgica do but-2-eno em presença do permanganato de potássio e ácido concentrado.
VII – Em condições adequadas, sua reação com sódio metálico produz etanoato de sódio e libera H2.
Das afirmativas feitas, estão corretas apenas
Em química orgânica existem várias apresentações de fórmulas, como fórmulas moleculares e percentuais. A fórmula molecular indica o número de átomos de cada elemento em uma molécula da substância. A fórmula percentual indica a porcentagem, em massa, de cada elemento que constitui a substância. Uma maneira de determinação dessa fórmula é a partir da fórmula molecular, aplicando-se conceitos de massa atômica e massa molecular.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 114
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; 3-metilbutanal e 2-metilbutanal.
Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua
fórmula percentual, aproximadamente 54,5 % em massa de carbono (C) na sua estrutura é o
Considere a reação química de formação de uma molécula de triglicerídeo.
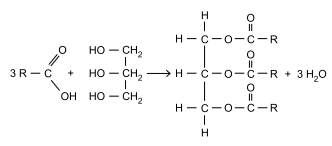
Sobre os reagentes e produtos, assinale a alternativa correta.
Analise a biomolécula.
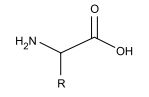
A biomolécula ilustrada é de um
O processo de obtenção sustentável do monômero é corretamente representado em:
Considere as substâncias I, II, III e IV cujas fórmulas estruturais são representadas nas figuras.
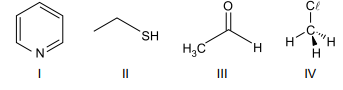
Formam interações intermoleculares do tipo ligação de
hidrogênio com a água as substâncias