Questões Militares de Química - Química Orgânica
Foram encontradas 374 questões
O que acontece ao se misturar cloreto de hidrogênio com propeno?
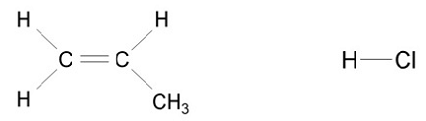
Fonte: Arquivo da Banca Elaboradora.
Analise as estruturas químicas a seguir.
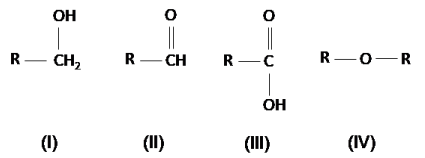
Fonte: Arquivo da Banca Elaboradora.
Segundos os grupos funcionais, podemos dizer que as substâncias I, II, III e IV, nessa ordem, são:
Em um laboratório havia 3 compostos orgânicos identificadas como I, II e III. Sob determinadas condições, observou-se que:
• As substâncias I e II reagem formando uma amida.
• As substâncias II e III reagem formando um éster.
• A substância III, caso mantida em um meio oxidativo e ácido, pode se transformar em II.
As substâncias I, II e III são, nessa ordem,
Anaiise os compostos abaixo, de 1 a 4:
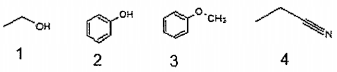
As funções orgânicas dos compostos acima são,
respectivamente:
Considere os seguintes álcoois:
I- n-butílico
II- iso-butílico
III- sec-butílico
IV- terc-butílico
Assinale a opção que apresenta os compostos acima em ordem crescente de ponto de ebulição.
Analise o composto abaixo.
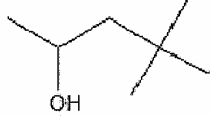
A nomenclatura IUPAC desse composto é:
Analise a reação abaixo.
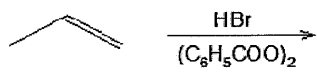
Na reação de adição de HBr ao propeno acima, o produto da reação é:
(Obs: (C6H5COO)2 é o peróxido de benzoílo.)
Analise o composto abaixo.
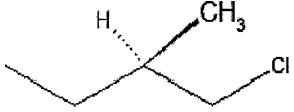
De acordo com o Sistema de Nomenclatura de
Enantiômeros de Cahn-Ingold-Prelog, o nome correto do
composto acima é:
O éter etílico é um composto orgânico que foi muito usado no passado como anestésico. Um dos métodos usados para sua obtenção é a desidratação intermolecular do etanol, como mostrado na reação abaixo.

Um químico deseja utilizar o mesmo método descrito
acima para sintetizar um éter assimétrico, o 2-etóxi-2-
metilpropano. Nesse caso, os álcoois de partida devem
ser
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Aminoácidos são compostos orgânicos que contêm um grupo amina e um grupo carboxílico. Nos α-aminoácidos, os dois grupos encontram-se nas extremidades da molécula e entre eles há um átomo de carbono, denominado carbono-α, que também está ligado a um grupo R, conforme a figura.
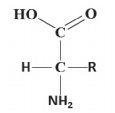
Considere os seguintes aminoácidos:
I. Alanina, em que R = CH3.
II. Asparagina, em que R = CH2CONH2.
III. Fenilalanina, em que R = CH2C6H5.
IV. Glicina, em que R = H.
V. Serina, em que R = CH2OH.
Assinale a opção que contém o(s) aminoácido(s) que possui(em) grupo(s) R polar(es).
Com relação a reações químicas e a substâncias, julgue o item subsequente.
As cadeias carbônicas são formadas por ligação linear entre
átomos de carbono, de oxigênio e de hidrogênio.
A respeito das propriedades químicas e físicas de determinados combustíveis, julgue o próximo item.
O etanol é uma substância inorgânica.
Considere as duas moléculas abaixo:
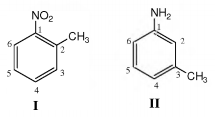
Ambas sofrerão nitração nos anéis aromáticos via substituição eletrofílica. Dentre as opções a seguir, a única
que indica posições passíveis de substituição nas moléculas I e II, respectivamente, é:
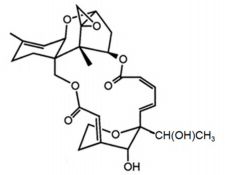
Dada a estrutura química da satratoxina-H abaixo, podemos afirmar que essa molécula possui: