Questões Militares
Comentadas sobre representação das transformações químicas em química
Foram encontradas 155 questões
A corrosão de objetos metálicos é acelerada em meio ácido. Supõe-se ter sido esse fator preponderante para o trágico desabamento de parte das arquibancadas do estádio da Fonte Nova, em Salvador – BA, em 2007, que causou a morte de 8 pessoas. Os torcedores tinham o hábito de urinar nas arquibancadas do estádio.
Como a estrutura de concreto é porosa, a urina, que contém ácidos e sais, penetrava e atingia a estrutura de ferro do estádio, o que causou a sua corrosão.
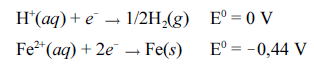
Tendo como base essas informações e considerando os potenciais padrão (E0) fornecidos para as semirreações acima, julgue o item subsequente.
A reação balanceada que representa a corrosão de uma peça de ferro pelo íon
H+ é H+(aq) + Fe(s)  1/2H2(g) + Fe2+(aq).
1/2H2(g) + Fe2+(aq).

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
I-mono-hidrogenossulfito de potássio + ácido clorídrico → ácido sulfuroso + cloreto de potássio
II-fosfato de cálcio + dióxido de silício + carvão → metassilicato de cálcio + monóxido de carbono + fósforo branco
4 C3H5(NO3)3(l) → 6 N2(g) + 12 CO(g) + 10 H2O(g) + 7 O2(g)
Considerando os gases acima como ideais, a temperatura de 300 Kelvin (K) e a pressão de 1 atm, o volume gasoso total que será produzido na detonação completa de 454 g de C3H5(NO3)3(l) é:
Dados:
Elemento H(hidrogênio) C( carbono) O ( Oxigênio) N( nitrogênio)
Massa 1 12 16 14
atômica(u)
Constante universal dos gases: R=8,2 · 10-2 atm · L · K-1 · mol-1
Bicarbonato 100,0
Cálcio 22,0
Sódio 8,98
Nitrato 4,11
Sulfato 6,00
Magnésio 3,26
Potássio 2,70
Cloreto 0,73
Fluoreto 0,34
Sabe-se que a massa molar do íon sulfato (SO42-) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é:
Cl2(g) + OH1-(aq) → Cl1-(aq) + ClO31-(aq) + H2O(l)
O carbonato de sódio (Na2CO3) empregado na fabricação de vidro é preparado a partir do carbonato de cálcio (CaCO3) e cloreto de sódio (NaCl), segundo a equação balanceada:
CaCO3 + 2 NaCl → Na2CO3 + CaCl2
Partindo-se de 1250 g de carbonato de cálcio (com grau de pureza de 80%) e 650 g de cloreto de sódio (com grau de pureza de 90%), a massa de carbonato de sódio (Na2CO3) obtida dessa reação, admitindo-se um rendimento da reação de 80%, será de:
Dados:
Massas atômicas: C=12u; O=16u; Na=23u; Cl=35,5u; Ca=40u

As fórmulas químicas das substâncias citadas nesse quadro são, na ordem, respectivamente:
Considerando que, na titulação do ácido sulfúrico formado no borbulhador, foram gastos 3,2 mol de NaOH e que o totalizador de volume indicou 4 m3 de amostra de ar, conclui-se que, nessa análise, a concentração de dióxido de enxofre no ar amostrado era de 8 × 10-4 mol / L.
De acordo com o texto, a concentração máxima de ácido benzoico permitida em bebidas refrigerantes é superior a 40 mmol/L.
Considerando-se que o rendimento da reação completa de combustão do butano seja de 100%, é correto afirmar que, para a queima completa de 116 g desse hidrocarboneto, seria necessária massa mínima de oxigênio superior a 410 g.


