Questões Militares
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 19 questões
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
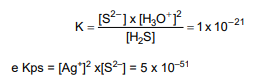
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
O Cu4(OH)6(SO4) é um sal pouco solúvel em água, conforme descrito na equação química abaixo:
Cu4(OH)6(SO4)(s) ⇌ 4Cu2+(aq) + 6OH-(aq) + SO42-(aq)
Assumindo que a concentração do íon OH-, na solução saturada, permanece constante e igual a 1,0x106 M, qual é a fórmula do produto de solubilidade da reação e a concentração do íon sulfato, respectiva mente?
Dado:
Produto de solubilidade do Cu4(OH)6(SO4):Kps=2,56 x 10-69
O hidróxido de magnésio é praticamente insolúvel na ausência de sais de amônio e tem um produto de solubilidade de 3,2x10-11 à temperatura ambiente. A dissociação desse hidróxido é representada por:
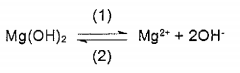
Calcule a concentração de íons hidroxila, em mol.L-1, em
uma solução aquosa saturada, e assinale a opção
correspondente.
“Quando um eletrólito é adicionado à água, independentemente se a solubilidade é alta ou baixa, ocorre a sua dissociação (liberação de íons) ou ionização (produção de íons). Porém, ao mesmo tempo, esses íons voltam a formar o eletrólito, ocorrendo um equilíbrio químico de dissolução.”
(Produto de solubilidade - Manual da Química (manualdaquimica.uol.com.br). Acesso em: 15/02/2018).
Considere os carbonatos apresentados na tabela abaixo e seus respectivos valores da constante de produto de solubilidade (Kps) a 25°C.

A partir dos dados da tabela, foram feitas as seguintes afirmações sobre as solubilidades molares.
I. Carbonato de zinco é mais solúvel do que carbonato de cádmio.
II. Carbonato de zinco é mais solúvel do que carbonato de prata.
III. Carbonato de prata é mais solúvel do que carbonato de cádmio.
É verdadeiro o que se afirma em:
Dado: Massa molecular relativa de CuCl = 99
O cloreto de chumbo II é ligeiramente solúvel em água, conforme descrito na equação química abaixo.
PbCl2(s)  Pb2+(aq) + 2Cl-(aq)
Pb2+(aq) + 2Cl-(aq)
Sabendo que a concentração do íon chumbo, na solução saturada, é de 0,02 mol/L, qual é o valor do produto de solubilidade do cloreto de chumbo II?
Dados:
Produto de solubilidade
(Kps) : Kps = [Pb2+] [ Cl- ] 2
[Pb2+ ] : concentração do íon Pb2+
[Cl-] : concentração do íon Cl-
Dado Kps(MX) = 5 x 10─12.
Considere o produto de solubilidade (K ps), a 25 0C , das substâncias I II e III:
I. Cα (OH)2; K ps = 5,0 × 10 −6II. Mg (OH)2; K ps = 5,6 × 10 −12
III . Zn (OH)2; K ps = 3,0 × 10 −17
Considere os seguintes dados: Kps AgCl = 1, 5.10-10 e Kps Ag2CrO4 = 3, 2 .10-12
Adicionando-se AgNO3 0,1M a uma solução que é 0,1M, em relação ao cloreto, e 2.10-3 M, em relação ao cromato, é correto afirmar que:
Ag+ (aq) + e-
 Ag(c); Eo = 0,799 e AgCl (c) + e-
Ag(c); Eo = 0,799 e AgCl (c) + e- 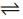 Ag(c) Cl- (aq); E = 0,222 V
Ag(c) Cl- (aq); E = 0,222 Vem que ο Eo é o potencial do eletrodo em relação ao eletrodo padrão de hidrogênio nas condições-padrão.
Uma solução aquosa saturada em fosfato de estrôncio [Sr3(PO4)2] está em equilíbrio químico à temperatura de 25 °C, e a concentração de equilíbrio do íon estrôncio, nesse sistema, é de 7,5 x 10–7 mol L–1.
Considerando-se que ambos os reagentes (água e sal inorgânico) são quimicamente puros, assinale a alternativa CORRETA com o valor do pKPS(25ºC) do Sr3(PO4)2.
Dado: KPS = constante do produto de solubilidade.