Questões Militares
Sobre sistemas homogêneos: equilíbrio iônico: conceitos, diluição de ostwald, efeito do íon comum. em química
Foram encontradas 15 questões
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente:
O cianeto de sódio (NaCN) é um sal usado principalmente na indústria de mineração para a recuperação de metais preciosos. É produzido industrialmente pela reação entre ácido cianídrico e hidróxido de sódio, sendo recuperado, após a sua purificação, na forma cristalina ou na forma de soluções contendo entre 27 e 32% m/m.
Sabendo-se que, à temperatura de 25°C, a constante de dissociação do NaCN em água é igual a Ka = 6,2x10-10, é correto afirmar que, para uma concentração igual a 6,25 mol.L-1 (~ 27% m/m), a solução é
Constantes de equilíbrio de ácidos fracos a 25 oC

Com base nas informações fornecidas, qual dos sais indicados a seguir é o mais eficiente como solução neutralizante?
H2S = H+ + HS- HS- = H+ + S-2
K1=1,1.10-⁷
K2=10-14
As reações acima representam a ionização do ácido sulfídrico em água. Numa solução de 0,11 M de H2S, quala [H+]?
Dados: Kw = [H30+] [OH- ] = 10-14 Ba(OH)2(s) → Ba+2(aq) + 20H-(aq)
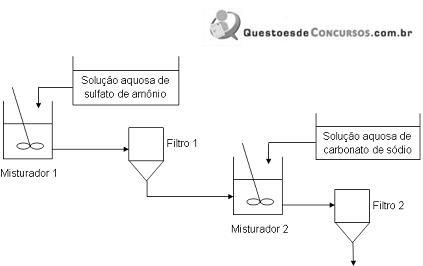
No Misturador 1, antes da adição de 100 mL de uma solução aquosa de sulfato de amônio 20 g/L, encontram-se 100 mL de uma solução aquosa composta por massas iguais de nitrato de prata, nitrato cúprico e nitrato de chumbo (II), de concentração total 60 g/L.
Ao Misturador 2, que contém o material passante do Filtro 1, adicionam-se 100 mL de uma solução aquosa de carbonato de sódio 40 g/L e uma pequena quantidade de uma solução de hidróxido de sódio objetivando o adequado ajuste do pH de precipitação para, em seguida, proceder a filtração. Sobre os produtos de filtração, pode se dizer que:
Dado Kps(MX) = 5 x 10─12.
Observe a tabela abaixo.
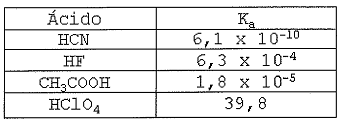
A tabela acima apresenta ácidos com suas respectivas constantes
de ionização (ka) . Assinale a opção que apresenta a
ordem decrescente de ionização desses ácidos.
Uma solução aquosa saturada de gás sulfídrico possui concentração igual a 0,1M e constante de ionização igual a 10-22 Calcule a concentração de sulfeto necessária para precipitação dos cátions do segundo Grupo, sabendo-se que o pH deve ser regulado para se obter uma solução 0,25M em ácido clorídrico, e assinale a opção correta.
Dados: H2S → 2 H+ + S-2
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas
Entretanto, dados experimentais de Ka e Kb não estão de acordo com esta estrutura mas, sim, com *NH3CHRCOO¯. Com relação aos aminoácidos e seus
grupos ácidos e básicos, é correto afirmar que:
Em cinco béqueres foram adicionados 50 mL de uma solução de referência, que consiste de uma solução aquosa saturada em cloreto de prata, contendo corpo de fundo, a 25 °C e 1 atm. A cada béquer, foram adicionados 50 mL de uma solução aquosa diluída diferente, dentre as seguintes:
I. Solução de cloreto de sódio a 25 °C.
II. Solução de Glicose a 25 °C.
III. Solução de Iodeto de sódio a 25 °C.
IV. Solução de Nitrato de prata a 25 °C.
V. Solução de Sacarose a 50 °C.
Considere que o corpo de fundo permanece em contato com as soluções após rápida homogeneização das
misturas aquosas e que não ocorre formação de óxido de prata sólido. Nestas condições, assinale a opção que
indica a(s) solução(ões), dentre as acima relacionadas, que altera(m) a constante de equilíbrio da solução de
referência.
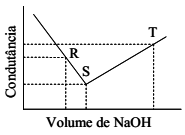
Uma solução aquosa de HCl 0,1 mol L–1 foi titulada com uma solução aquosa de NaOH 0,1 mol L–1. A figura ao lado apresenta a curva de titulação obtida em relação à condutância da solução de HCl em função do volume de NaOH adicionado.
Com base nas informações apresentadas nesta figura, assinale a opção ERRADA.