Questões Militares
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 25 questões
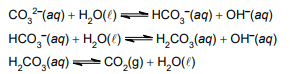
A solução tampão formada nesse sistema envolve o par conjugado ácido-base, nessa ordem:
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas

Com base nessas informações, é correto afirmar que:
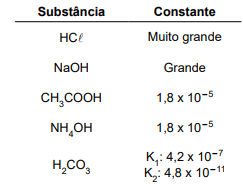
Considere a tabela dos valores de Kw a diferentes temperaturas.
T (ºC) Kw
10 0,29 × 10–14
15 0,45 × 10–14
20 0,68 × 10–14
25 1,01 × 10–14
30 1,47 × 10–14
50 5,48 × 10–14
Os valores de Kw mostram que, a 50 ºC, o pH da água
pura é
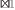 1, na solução resultante é igual a
1, na solução resultante é igual a Anodo, H2 → 2H+ + 2e- (E° = 0 V) Catodo, Br2 + 2e- → 2Br- (E° = 1,087 V)
A dissociação da água pode ser observada pelo efeito da seguinte semirreação:
O2 + 4e-+ 4H+ → 2H2O E° = 1,229 V
A formação de complexos iônicos de polibrometo ocorre segundo as reações e suas respectivas constantes de equilíbrio:
Br2 + Br- ⇌ Br3- K3 = 16,7 2Br2 + Br- ⇌ Br5- K5 = 37,7
Sejam feitas as seguintes afirmações a respeito dessa bateria:
I. O potencial da célula pode ser aproximado pela equação: Ecatodo - Eanodo = 1,087 + 0,06 pH. II. O solvente (água) é termodinamicamente estável somente a pH < 2,4.
III. Recarregar a bateria com um potencial catódico inferior a 1,229 V garante a estabilidade do solvente. IV. Durante a descarga da bateria, a concentração do HBr aumenta e podem formar complexos ionicos de Br3- e Br5-.
Das afirmações acima, estão CORRETAS
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o
Considerando que: - a solução básica foi parcialmente neutralizada pela solução do ácido; - o ácido clorídrico é um ácido forte (α=100%); - o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
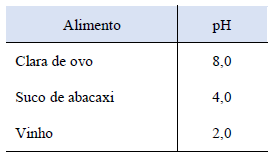
Com base nas informações da tabela abaixo, assinale a alternativa CORRETA.
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)